Ur-o-test 10S
DIMDI-Reg.-Nr.: DE/CA22/1116-164-IVD
TESTSTREIFEN FÜR DIE URINANALYSE
Für den semi-quantitativen und qualitativen Nachweis von Glucose, Bilirubin, Keton, Blut, Urobilinogen, Nitrit Leukozyten und Ascorbinsäure in Urin und die Bestimmung des pH und der Dichte (Spezifisches Gewicht) mit Clintek 50, 100, 200, 500, Status, Advantus und manuelle Anwendung
VERWENDUNGSZWECK
Bei den BGT Urinteststreifen handelt es sich um feste Kunststoffstreifen, auf denen sich verschiedene Reagenzzonen befinden. Je nach Test stellen BGT Urinteststreifen Tests für den semiquantitativen Nachweis von Glucose, Bilirubin, Keton, Spezifizisches Gewicht (Dichte), Blut, pH, Eiweiß, Urobilinogen, Nitrit, Leukozyten und Ascorbinsäure im Urin zur Verfügung. Die Testergebnisse können Aufschluss über den Status des Kohlenhydratstoffwechsels, über die Nieren- und Leberfunktion, des Säure-Basen-Gleichgewichts und Bakteriurie geben.1,2 Sowohl auf der Kartonverpackung als auch auf dem Dosenetikett finden Sie die jeweiligen Parameter des verwendeten Produkts.

TESTPRINZIP
Die BGT Urinteststreifen sind mit einem Trockenmittel in einer Kunststoffrunddose mit Drehverschluss verpackt. Die Urinteststreifen sind sofort bei Entnahme aus der Dose gebrauchsfertig. Der gesamte Teststreifen kann anschließend weggeworfen werden. Die Testergebnisse erhält man durch direkten Farbvergleich der Reagenzfelder mit den Feldern auf dem Etikett der Runddose. Zur Durchführung des Tests sind keine weiteren Laborgeräte erforderlich. Die untenstehenden Farbfelder dienen nur der Informa-tion und stimmen nicht unbedingt mit den Ergebnisfeldern überein. Zur Überprüfung der Testergebnisse verwenden Sie bitte die Farbfelder auf den Runddosen.
FUNKTIONSPRINZIP DES TESTS
LEUKOZYTEN: Diesem Test liegt die Wirkung der in Leukozyten vorhandenen Esterase zugrunde, die die Hydrolyse eines Napthylester-Derivats katalysiert. Das freigesetzte Naphthol reagiert mit einem Diazoniumsalz, und dabei entsteht eine Färbung zwischen beige und rosarot bis hin zu violett.

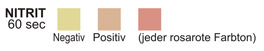
NITRIT: Diesem Test liegt die Umsetzung von Nitrat zu Nitrit durch die Wirkung gramnegativer Bakterien im Urin zugrunde. Das Nitrit reagiert in saurem Milieu mit p-Arsanilsäure zu ein Diazoverbindung. Die Diazoverbindung ihrerseits wird an 1,2,3,4,-Tetrahydrobenzochinon gekoppelt. Dabei entsteht eine rosarote Farbe.
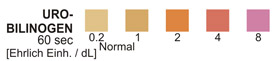
UROBILINOGEN: Diesem Test liegt die Ehrlich-Probe zugrunde, bei der p-Dimethyl-aminobenzaldehyd in stark saurem Milieu mit Urobilinogen reagiert. Dabei kommt es zur Entwicklung einer braun-orangen Farbe.
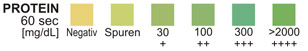
PROTEIN: Diesem Test liegt das Protein-Indikatorfehler-Prinzip zugrunde. Bei kon-stantem pH ist die Entstehung einer Grünfärbung, egal welcher Art, auf das Vorhan-densein von Protein zurückzuführen. Die Farben reichen von gelb für negative über gelb-grün und grün bis hin zu grün-blau für positive Reaktionen.
pH: Diesem Test liegt ein Doppelindikatorprinzip zugrunde, das eine breite Farbpalette ergibt, die den gesamten pH-Bereich im Urin abdeckt. Die Farben reichen von orange, über gelb und grün, bis hin zu blau.

BLUT: Diesem Test liegt die peroxidaseähnliche Aktivität des Hämoglobins zugrunde, das die Reaktion von Kumol-Hydroperoxid mit 3,3’,5,5’-Tetramethylbenzidin katalysiert. Die dabei entstehende Farbe reicht von orange über grün bis hin zu dunkelblau.

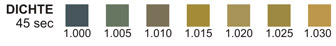
DICHTE: Diesem Test liegt die scheinbare pKa-Verschiebung bestimmter vorbe-handelter Polyelektrolyte relativ zur Ionenkonzentration zugrunde. In Gegenwart eines Indikators reichen die Farben bei geringen Ionenkonzentrationen im Urin von tiefem blau-grün bis hin zu grün und gelb-grün bei steigenden Ionenkonzentrationen.
KETON: Diesem Test liegt die Reaktion zwischen Acetessigsäure und Nitroprussid zugrunde. Die Farben reichen von hellbraun bei negativem Ergebnis über rosa bis violett bei positiven Ergebnissen.

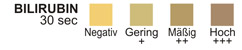
BILIRUBIN: Diesem Test liegt die Kopplung des Bilirubins an ein diazotiertes Dichloranilin in einem stark sauren Milieu zugrunde.
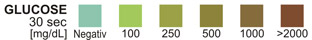
GLUCOSE: Diesem Test liegt eine doppelte sequentielle Enzymreaktion zugrunde. Das Enzym Glucoseoxidase katalysiert die Bildung von Glukonsäure und Wasserstoff-peroxid aus der Oxidation von Glucose. Ein zweites Enzym, Peroxidase, katalysiert die Reaktion von Wasserstoffperoxid mit einem Kaliumjodid-Chromogen, bei der das Chromogen oxidiert wird, so dass es zu einer Färbung zwischen grün und braun kommt.
REAGENZIEN (Trockengewicht zum Zeitpunkt der Durchtränkung)
GLUCOSE: 1,5 Gew.-% Glucosesoxidase (Aspergillusniger, 1,3 IE); 0,5 Gew.-% Peroxidase (Meerrettich, 3300 IE); 10,0 Gew.-% Kaliumjodid; 75,0 Gew.-% Pufferlösung und 13,0 Gew.-% nichtreaktive Bestandteile.
BILIRUBIN: 0,5 Gew.-% 2,4-Dichloranilin-Diazoniumsalz, mit 99,5 Gew.-% Pufferlösung und nichtreaktiven Bestandteilen ausgeglichen.
DICHTE: 2,5 Gew.-% Bromthymolblau; 17,5 Gew.-% Puffer und nichtreaktive Bestandteile, 55 Gew.-% Poly (Methylvinylether/Maleinsäure); 25 Gew.-% Natriumhydroxid.
BLUT: 4 Gew.-% 3,3,5,5-Tetramethylbenzidin (TMB); 6 Gew.-% Cumolhydroperoxid, 90 Gew.-% Pufferlösung und nichtreaktive Bestandteile.
KETON: 5,0 Gew.-% Natrium-Nitroprussid, 95 Gew.-% Pufferlösung,
pH: 0,5 Gew.-% Methylrot; 5 Gew.-% Bromthymolblau; 94,5 Gew.-% nichtreaktive Bestandteile.
PROTEIN: 0,3 Gew.-% Tetrabromphenolblau; 99,7 Gew.-% Pufferlösung und nichtreaktive Bestandteile.
UROBILINOGEN: 2,5 Gew.-% p-Dimethylaminobenzaldehyd, 97,5 Gew.-% Pufferlösung und nichtreaktiven Bestandteilen.
NITRIT: 4,5 Gew.-% p-Arsanilsäure, 95,5 Gew.-% nichtreaktive Bestandteilen.
LEUKOZYTEN: 0,5 Gew.-% Naphthylester-Derivat, 0,4% Gew.-% Diazoniumsalz; 32 Gew.-% Pufferlösung und 67,1 Gew.-% nichtreaktive Bestandteile.
WARNHINWEISE UND VORSICHTSMASSNAHMEN
URINTESTSTREIFEN SIND NUR FÜR DIAGNOSTISCHE IN VITRO-VERSUCHE GEEIGNET.
LAGERUNG
Bei einer Temperatur von 15-30°C lagern und nicht dem direkten Sonnenlicht aussetzen. Nach Ablauf des Verfalldatums nicht mehr verwenden.
EMPFOHLENE HANDHABUNG
Alle ungebrauchten Teststreifen müssen in der Originalflasche aufbewahrt werden. Die Umlagerung in einen anderen Behälter kann zu einer Beeinträchtigung der Reagenzstreifen und einem Verlust ihrer Reaktivität führen. Trockenmittel nicht aus der Flasche herausnehmen. Nach dem ersten Öffnen Teststreifen innerhalb von 3 Monaten aufbrauchen.
PROBENNAHME UND VORBEREITUNG
Urin in einem sauberen Behälter gemäß Richtlinie NCCLS GP16-T sammeln und schnellstmöglich testen. Kann der Test nicht innerhalb einer Stunde nach der Probennahme durchgeführt werden, Probe unverzüglich kühl stellen und vor Durchführung des Tests wieder auf Raumtemperatur bringen. Ein längeres Stehenlassen des unbehandelten Urins bei Raumtemperatur kann zu starkem Mikrobenwachstum und folglich auch zu Änderungen des pH-Wertes führen. Eine Verschiebung in den basischen pH-Bereich kann zu falsch-positiven Ergebnissen in der Proteintestzone führen. Der pH-Wert glucosehaltigen Urins kann in dem Maße sinken, wie Organismen die Glucose umsetzen. Eine Kontamination der Urinprobe mit chlorhexidinhaltigen Hautdesinfektionsmitteln kann die Protein-Testergebnisse beeinträchtigen.
MITGELIEFERTE MATERIALIEN
- 1 Dose mit 100 BGT Teststreifen.
- Eine Farbtabelle zum visuellen Ablesen der Testergebnisse ist auf der Flasche aufgedruckt.
ERFORDERLICHE, JEDOCH NICHT MITGELIEFERTE MATERIALIEN
- Eine Uhr mit Sekundenanzeige (z.B. Stoppuhr).
Es wird ebenfalls empfohlen, dass zu Qualitätssicherungszwecken handelsübliche Kontrollen verwendet werden.
TESTDURCHFÜHRUNG MUSS GENAU BEFOLGT WERDEN, UM ZUVERLÄSSIGE TESTERGEBNISSE ZU ERZIELEN
Einen Teststreifen aus der Flasche herausnehmen und Deckel unverzüglich wieder fest verschließen. Die Reagenzzonen des Teststreifens vollständig in FRISCHEN Urin eintauchen und sofort wieder herausziehen, um ein Herauslösen der Reagenzien zu vermeiden.Den Teststreifen beim Herausziehen am Rand des Urinbehälters abstreifen, um überschüssigen Urin zu entfernen. Den Streifen dann waagerecht halten und die Kante des Teststreifens mit einem saugfähigen Material in Berührung (Papierhandtuch) bringen, um eine eventuelle Vermischung der Chemikalien aus benachbarten Reagenzzonen und/oder eine Verschmutzung der Hände zu vermeiden.
Die Reagenzzonen zum angegebenen Zeitpunkt mit der entsprechenden Farbtabelle auf dem Dosenetikett vergleichen.
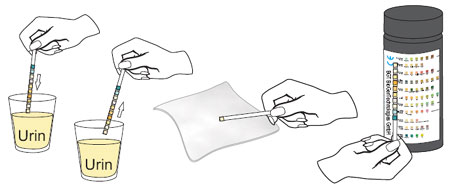
DEN TESTSTREIFEN GANZ NAH AN DIE FARBFELDER HALTEN UND GENAU VERGLEICHEN.
QUALITÄTSSICHERUNG
Um bestmögliche Ergebnisse zu erzielen, sollte die Funktionsfähigkeit der Reagenzstreifen anhand bekannter negativer bzw. positiver Proben oder Kontrollen bestätigt werden, sobald eine neue Flasche zum ersten Mal geöffnet wird.
Jedes Labor sollte angemessene Leistungsstandards setzen und Handhabungs- sowie Testverfahren in Frage stellen, wenn diese Standards nicht eingehalten werden.
ERGEBNISSE
Ergebnisse erhält man durch direkten Vergleich mit den Farbfeldern, die auf dem Dosenetikett aufgedruckt sind. Die Farbfelder stellen Nennwerte dar; Istwerte schwanken um die Nennwerte.
EINSCHRÄNKUNGEN DER FUNKTIONSFÄHIGKEIT
GLUCOSE: Große Mengen von Ketonen (50 mg/dl oder mehr) können die Farb-ausprägung beeinflussen. Es ist jedoch unwahrscheinlich, dass das gleichzeitige Vor-handensein von Ketonen und Glucose im Urin ausreicht, um zu falsch-negativen Ergebnissen zu führen. Bei Glucosekonzentrationen von 1 g/dl oder mehr erscheint die Farbe eventuell etwas ungleichmäßig. Bei der Auswertung der Ergebnisse anhand der Farbtabelle sollte die dunkelste Farbe zugrundegelegt werden. Die Reaktivität des Glucosetests nimmt mit zunehmender Dichte des Urins ab. Die Reaktivität kann sich eventuell auch mit der Temperatur ändern.3
BILIRUBIN: Bei Proben mit hohen Konzentrationen von Chlorpromazin oder Rafampen kann es zu Reaktionen kommen, die fälschlicherweise für positive Bilirubin-Werte gehalten werden könnten.3 Indican (Indoxylsulfat) und Metaboliten von Lodine können zu falsch-positiven Ergebnissen oder einer atypischen Färbung führen; Ascorbinsäure (25 mg/dl oder mehr) kann zu falsch-negativen Ergebnissen führen.
KETON: Farbreaktionen, die als „positive“ Ergebnisse interpretiert werden könnten, können bei Urinproben mit MESNA oder größeren Mengen an Phenylketonen oder Levodopa-Metaboliten zustandekommen.3
DICHTE: Da es sich um einen chemischen Dichtetest handelt, kann es bei erhöhten Werten für bestimmte Urinbestandteile zu geringfügigen Unterschieden gegenüber den Ergebnissen kommen, die anhand anderer Dichtebestimmungsmethoden erzielt wer-den. Hochgepufferte basische Urinproben können im Vergleich zu anderen Methoden niedrige Werte ergeben. Bei Vorhandensein mäßiger Proteinmengen (100 – 750 mg/dl) kann es zu erhöhten Dichte-Werten kommen.
BLUT: Die Sensitivität des Blutnachweises ist bei Urin mit hoher Dichte und/oder hohem Ascorbinsäureanteil reduziert. Mikroben-Peroxidase im Zusammenhang mit einer In- fektion der Harnwege kann zu einer falsch-positiven Reaktion führen.pH: Wird der Verfahrensablauf nicht genau eingehalten, und verbleibt überschüssiger Urin auf dem Teststreifen, kann es zu dem als „Überlauf“ bekannten Phänomen kommen, bei dem der Säurepuffer aus dem Protein-Reagenz in die pH-Testzone gelangt und dort zu einer verfälschenden Senkung des pH-Ergebniswertes führt.
PROTEIN: Falsch-positive Ergebnisse können mit hochgepufferten oder basischen Urinproben erzielt werden. Eine Kontamination der Urinprobe mit quaternären Ammoniumverbindungen kann ebenfalls zu falsch-positiven Ergebnissen führen.3
UROBILINOGEN: Die Testzone reagiert mit störenden Substanzen, die bekannter-maßen mit Ehrlich-Reagenzien reagieren, wie zum Beispiel Porphobilinogen und p-Aminosalicylsäure.3 Der Test ist keine zuverlässige Nachweismethode für Porpho-bilinogen. Medikamente, die Azofarbstoffe enthalten, (Azo Gantrisin), können die Reaktion mit einer goldenen Farbe überdecken. Das Nichtvorhandensein von Urobilinogen kann mit diesem Produkt nicht nachgewiesen werden.
NITRIT: Die rosarote Farbe ist nicht quantitativ bezogen auf die Anzahl der vorhan-denen Bakterien zu sehen. Jede rosarote Farbstufe ist als positives Nitrit-Testergebnis zu werten, das auf das Vorhandensein von 105 oder mehr Organismen/ml hindeutet. Es gibt gelegentlich Infektionen der Harnwege durch Organismen, die keine Reductase zur Umsetzung von Nitrat zu Nitrit enthalten.
LEUKOZYTEN: Es wurde festgestellt, dass stark gefärbter Urin und das Vorhandensein der Medikamente Cephalixin (Kelfex) und Gentamicin das Testergebnis beeinträchtigen können. Ein Proteingehalt im Urin von mehr als 500 mg/100 ml kann die Intensität der Reaktionsfärbung mindern. Hohe Glucosekonzentrationen bzw. eine hohe spezifische Dichte können den Leukozytenwert reduzieren.
ASCORBINSÄURE: Es sind keine Substanzen im Urin bekannt, die den Ascorbinsäureparameter beeinträchtigen können.
ERWARTETE WERTE
GLUCOSE: Die Nieren scheiden normalerweise kleine Mengen Glucose aus.5 Konzentrationen von nur 0,1 g Glucose/dl, die nach 10 bzw. 30 Sekunden abgelesen werden, sind vermutlich dann deutlich abnorm, wenn sie immer wieder festgestellt werden. Nach 10 Sekunden dürfen die Ergebnisse nur qualitativ ausgewertet werden; das heißt entweder negativ oder positiv. Sind quantitative Ergebnisse gewünscht, darf das Ergebnis nur nach 30 Sekunden ausgewertet werden.
BILIRUBIN: Normalerweise ist im Urin nicht einmal mit äußerst empfindlichen Ver-fahren Bilirubin nachzuweisen. Bereits Spuren von Bilirubin sind hinreichend abnorm und erfordern eine eingehendere Untersuchung. Atypische Farben (entstandene Farben, die sich sowohl von den negativen als auch von den positiven Farbfeldern auf der Farbtabelle unterscheiden) deuten eventuell darauf hin, dass die aus dem Bilirubin stammenden Gallenfarbstoffe in der Urinprobe vorhanden sind und eventuell die Bilirubinreaktion überdecken.
KETON: Normalerweise sind keine Ketone im Urin vorhanden. Zu nachweisbaren Ketonmengen im Urin kann es in physiologischen Stress-Situationen kommen, wie zum Beispiel während Reduktionsdiäten, bei Schwangerschaft und häufiger anstrengender körperlicher Betätigung.6-8 Bei Hungerkuren oder anderen abnormen Zuständen des Kohlenhydratstoffwechsels kommt es zu überhöhten Ketonmengen im Urin, noch bevor die Serumketonwerte erhöht sind.10
DICHTE: Urin-Stichproben können in ihrer Dichte zwischen 1,003 und 1,040+ schwan-ken. Urinproben, die über 24 Stunden bei normalen Erwachsenen mit normaler Ernährung und normaler Flüssigkeitsaufnahme genommen wurden, weisen eine Dichte zwischen 1.016 und 1,022 auf.9 Bei schweren Nierenschäden liegt die Dichte bei 1,010, dem Wert für das glomeruläre Filtrat.
BLUT: Eventuelle blaue Flecken oder eine Blaufärbung der Reagenzzone innerhalb von 40 Sekunden ist relevant, und der Urin sollte eingehender untersucht werden. Im Urin menstruierender Frauen wird häufig, jedoch nicht immer, Blut festgestellt.
pH:3 Neugeborene: 5 – 7, später 4,5 – 8 Durchschnitt: 6
PROTEIN: Im 24-Stunden-Urin kann die normale Niere 1 – 14 mg Protein in 1 dl Urin ausscheiden.4 Eine Farbe, die einem Farbfeld für mehr als Spurenkonzentration entspricht, weist auf deutliche Proteinurie hin. Bei Urin mit hoher Dichte kann die Testzone dem Farbfeld für Spurenkonzentrationen extrem gleichen, auch wenn nur normale Proteinkonzentrationen vorhanden sind. Eine klinische Bewertung ist erforder-lich, um die Bedeutung von Spuren-Ergebnissen zu bewerten.
UROBILINOGEN: Bei der gesunden Bevölkerung liegt der in diesem Test erzielte normale Urobilinogen-Bereich bei 0,1 – 1,0 Ehrlich-Einheiten pro dl.
NITRIT: Normalerweise ist kein Nitrit im Urin vorhanden.3 Die Nitrit-Testzone wird in einem Teil der Fälle mit deutlicher Infektion positiv ausfallen, je nachdem, wie lange die Urinproben vor dem Entleeren der Blase und somit der Probenahme verhalten worden sind. Die Feststellungsquote positiver Fälle beim Nitrit-Test liegt zwischen nur 40% in Fällen mit kurzer Blaseninkubation und bis zu etwa 80% in Fällen mit einer Mindestinkubationszeit von 4 Stunden.
LEUKOZYTEN: Normale Urinproben ergeben bei diesem Test in der Regel negative Ergebnisse. Ein Spurenergebnis hat unter Umständen eine zweifelhafte klinische Aussagekraft, und es wird in einem solchen Fall empfohlen, den Test mit einer frischen Urinprobe des selben Patienten zu wiederholen. Wiederholte positive Spurenergeb-nisse sind allerdings von klinischer Relevanz.
ASCORBINSÄURE: Die tägliche Abgabe von Ascorbinsäure in den Harn variiert je nach Aufnahme: es ist ungefähr die Hälfte der Aufnahme. Die durchschnittliche Abgabe in den Harn beträgt ungefähr 20-30 mg/Tag. Wenn Ascorbinsäure nachgewiesen wurde, sollte die Aufnahme von Ascorbinsäure für 24 Stunden aussetzen und dann erneut getestet werden.
SPEZIFISCHE LEISTUNGSMERKMALE
Die Leistungsmerkmale des BGT Urinteststreifens sind sowohl im Labor als auch in klinischen Tests ermittelt worden.Für den Benutzer bedeutsame Parameter sind Sensitivität, Spezifität, Sicherheit und Genauigkeit. Dieser Test wurde so entwickelt, dass er in der Regel spezifisch auf den zu messenden Bestandteil reagiert, mit Ausnahme der störenden Substanzen, die bereits aufgeführt wurden (siehe “Einschränkungen der Funktionsfähigkeit”).
Bei visuell abgelesenen Teststreifen ist die Sicherheit eine Funktion der Art und Weise, auf die die Farbfelder auf dem Flaschenetikett zugeordnet werden, sowie des Unterscheidungsvermögens des menschlichen Auges bei der Testauswertung. Die Genau-igkeit ist bei einem Test dieser Art aufgrund der Ungleichheit des menschlichen Sehver-mögens schwer zu beurteilen. Aus diesem Grunde werden die Benutzer aufgefordert, ihre eigenen Leistungsstandards zu erstellen.
SENSITIVITÄT
GLUCOSE-TEST: Die Reagenz-Testzone kann entweder nach 10 Sekunden (qualitatives Ergebnis) oder nach 30 Sekunden (quantitatives Ergebnis) abgelesen werden. Der Test reagiert spezifisch auf Glucose – keine andere Substanz, die in den Urin ausgeschieden wird, erbringt hier bekanntermaßen ein positives Ergebnis.
Die Reagenzzone reagiert weder mit Lactose, Galactose, Fructose noch mit reduzierenden Metaboliten von Medikamenten, z. B. Salicylaten und Nalidixinsäure.
Der Test kann verwendet werden um nachzuweisen, ob es sich bei der im Urin festgestellten reduzierenden Substanz um Glucose handelt. Der Nachweisbereich liegt zwischen 50 und 100 mg/dL(2,5-5 mmol/L).
BILIRUBIN-TEST: Der Test hat eine Sensitivität von 0,4 – 1,0 mg/dl (6,8-17µmol/L). Der Test gilt als spezifisch für Biliburin im Urin.
KETON-TEST: Die Keton-Testzone erbringt semiquantitative Ergebnisse (wenig, mittel, viel) und reagiert mit der Acetessigsäure im Urin. Sie reagiert nicht mit Hydroxybuttersäure oder Aceton.
Die Reagenzzone weist bereits Konzentrationen von 2,5 – 5 mg/dl (0.25-0.5 mmol/L) Acetessigsäure im Urin nach.
DICHTE: Der Dichte-Test erlaubt eine Bestimmung der Urindichte in einem Bereich zwischen 1,000 und 1,030. In der Regel korreliert er auf bis zu 0,005 mit dem bei der Brechungsindexmethode ermitteltenWerten.
BLUT-TEST: Zum Zeitpunkt der Reagenzherstellung hat der Test bei ordnungsgemäßer Ablesung eine Sensitivität von 0.018 – 0,060 mg/dl gegenüber freiem Hämoglobin bzw. von 5-10 intakten roten Blutkörperchen/μL bei ascorbinsäurehaltigem Urin < 50 mg/dL. Der Test ist etwas sensitiver gegenüber freiem Hämoglobin und Myoglobin als gegenüber intakten Erythrozyten.
pH-TEST: Die pH-Testzone ermöglicht eine quantitative Bestimmung der pH-Werte im Bereich zwischen 5 und 9 auf eine Einheit genau. pH-Werte werden nicht durch Änderungen der Urinpufferkonzentration beeinträchtigt.
PROTEIN-TEST: Diese Testzone liefert quantitative Ergebnisse. Es können zwischen 7,5 und 15 mg (0,075-0.15 g/L) Albumin pro dl Urin nachgewiesen werden (Spurennachweis). Die Testzone ist sensitiver gegenüber Albumin als gegenüber Globulin, Hämoglobin und Mukoprotein: ein negatives Ergebnis schließt daher nicht unbedingt das Vorhandensein der anderen Proteine aus.
UROBILINOGEN-TEST: Diese Testzone erbringt quantitative Ergebnisse und weist Urobilinogen im Urin in Konzentrationen von 0,2 – 1,0 mg/dL (3,5 – 17 µmol/L) nach.
Bei dem Test kann allerdings nicht festgestellt werden, ob in der getesteten Probe kein Urobilinogen vorhanden ist.
NITRIT-TEST: Zum Zeitpunkt der Reagenzherstellung hat der Test eine Sensitivität gegenüber Natriumnitrit von 0,05 – 0,1 mg/dl in Urin mit niedriger Dichte und einem Ascorbinsäuregehalt von weniger als 30 mg/dL. Ein Vergleich des umgesetzten Reagenz auf weißem Hintergrund kann zum Nachweis niedriger Konzentrationen beitragen, die normalerweise übersehen werden.
Der Test reagiert spezifisch auf Nitrit und reagiert mit keiner anderen Substanz, die normalerweise in den Urin ausgeschieden wird.
LEUKOZYTEN-TEST: Dieser Test hat eine Nachweisempfindlichkeit von bis zu 9-15 Leukozyten/μL. Dieser Test spricht nicht auf Erythrocyten oder Bakterien an, die häufig im Urin vorkommen.
LITERATUR
- Free, A.H and Free, H.M.: Urinalysis, Critical Discipline of Clinical Science. CRC Crit. Rev. Clin. Lab. Sci. 3(4): 481-531; (1972).
- Yoder, J.Adams, E.C., and Free. H.M.: Simultaneous Screening for Urinary Occult Blood, Protein, Glucose and pH. Amer. J. Med Tech. 31:285; (1965).
- Tietz, N.W.: Clinical Guide to Laboratory Tests; W.B. Saunders Company, (1976).
- Burtis, C.A. and Ashwood, E.R.: Tietz Textbook of Clinical Chemistry 2nd Ed. 2205; (1994).
- Shchersten, B. and Fritz, H.: Subnormal Levels of Glucose in Urine. JAMA 201:129-132; (1967).
- McGarry, J.D.: Lilly Lecture, 1978: New Perspectives in the Regulation of Ketogenesis. Diabetes 28: 517-523 May, (1978).
- Williamson, D.H.: Physiological ketoses, or Why Ketone Bodies? Postgrad. Med. J. (June Suppl.): 371-375: (1971).
- Paterson, P. et al.: Maternal and Fetal Ketone Concentrations in Plasma and Urine. Lancet: 862-865; April 22, (1967).
- Fraser, J. et al.: Studies with a Simplified Nitroprusside Test for Ketone Bodies in Urine, Serum, Plasma and Milk. Clin. Chem. Acta II: 372-378; (1965).
- Henry, J.B. et al.: Clinical Diagnosis and Management by Laboratory Methods, 16th Ed. Philadelphia: Saunders; (1979).
*Trademark:Lodine is a registered trademark of Wyeth-Ayerst Laboratories.Azo Gantrisin and Azo Gantanol are registered trademarks of Roche Labora-tories. Keflex is a registered trademark of Dista Products Company.
Abrechnung
| |
Nr. |
Preis in € |
| GOÄ |
3511 |
2,91 |
| EBM |
32030 |
0,50 |
Qualitätssicherung und Vorkommnisse
Sollten Sie den Eindruck eines Qualitätsmangels haben oder unklare oder ihrerseits falsch-positive oder falsch-negative Ergebnisse erhalten, bitten wir Sie, die betreffende Patientenprobe zurückzustellen und für einen Abruf für uns bereitzuhalten.
Bitte informieren Sie uns umgehend. Sie helfen uns dadurch die Sicherheit der Produkte und damit die Qualität zu gewährleisten.
 |
Hersteller: |

Günter Keul GmbH
Von-Langen-Weg 10
D-48565 Steinfurt
Tel.: 02551/2097 Fax.: 02551/80883
Web: www.keul.de
|
(akt. 14.09.2011)
|