Keul-o-test®
Campylobacter spp.
KGST305
Ein schneller Ein-Schritt-Test für den qualitativen Nachweis von Campylobacter spp. in Fäces. Nur für den professionellen Gebrauch in der In vitro-Diagnostik.
Verwendungszweck
Der Campylobacter-Test ist ein immunchromatographischer Schnelltest (ein nicht-invasiver Assay) für den qualitativen Nachweis von Campylobacter spp. in Fäces-Proben. Der Test dient zur Verwendung in der Diagnose von Campylobacteriose.
Zusammenfassung
Bei der Campylobacteriose handelt es sich um eine Infektionskrankheit, die durch Bakterien der Gattung Campylobacter verursacht werden. Bei der Mehrzahl der an Campylobacteriose erkrankten Patienten treten innerhalb von zwei bis fünf Tagen nach dem Kontakt mit dem Krankheitserreger Durchfall, Krämpfe, Unterleibsschmerzen und Fieber auf. Der Durchfall kann ein blutiges Erscheinungsbild aufweisen und zusammen mit Übelkeit und Erbrechen auftreten. Die Krankheitsdauer beträgt im Regelfall eine Woche. Bei einigen Infizierten treten keinerlei Symptome auf. Bei Personen mit einem geschwächten Immunsystem gelangt Campylobacter in einigen Fällen in den Blutkreislauf und verursacht ernste, lebensbedrohliche Infektionen.
Prinzip
Der Campylobacter-Test ist ein qualitativer immunchromatographischer Assay für den Nachweis von Campylobacter spp. in Fäces-Proben. Die Membran der Testvorrichtung ist im Bereich der Testbande mit monoklonalen Antikörpern gegen Campylobacter-Antigene vorbeschichtet.
Während der Testdurchführung reagiert die Probe mit den farbigen Partikeln (monoklonale anti-Campylobacter Antikörper – rote Polystyren-Microsphären), die auf dem Teststreifen aufgetrocknet sind. Die Mischung aus Probe und Farbpartikeln wandert durch Kapillarwirkung entlang der Membran. Bei einem positiven Ergebnis reagieren die spezifischen Antikörper auf der Membran mit dem entstandenen farbigen Konjugat und bilden eine Farbbande. Die Mischung wandert weiter entlang der Membran zu der Position der Kontrollbande, an der sich immobilisierter Antikörper befindet. Unabhängig vom Testergebnis erscheint im Bereich der Kontrollbande immer eine grüne Farbbande. Das Erscheinen dieser grünen Bande dient als ein Nachweis, dass ein ausreichendes Volumen pipettiert wurde, die Mischung korrekt gewandert ist sowie als interne Kontrollen für die Reagenzien.
Vorsichtsmaßnahmen
- Nur für den professionellen Gebrauch in der In vitro-Diagnostik.
- Verwenden Sie das Produkt nach Ablauf des Verfallsdatums nicht mehr.
- Der Test sollte erst unmittelbar vor der Verwendung aus der Folientasche entnommen werden.
- Verwenden Sie den Test nicht, wenn die Folientasche beschädigt ist.
- Befolgen Sie die Grundsätzen Guter Laborpraxis. Tragen Sie Schutzkleidung und verwenden Sie Einweghandschuhe, Essen, trinken oder rauchen Sie nicht am Arbeitsplatz.
- Alle Proben sollte als mögliche Risikostoffe eingestuft und entsprechend infektiösem Material (Krankheitserregern) behandelt werden.
- Nach der Testdurchführung sollte die Testvorrichtung in einem geeigneten Behälter für biologische Risikostoffe entsorgt werden.
- Die Testdurchführung muss innerhalb von 2 Stunden nach dem Öffnen der versiegelten Folientasche erfolgen.
Lagerung und Stabilität
Lagern Sie das Produkt in der ungeöffneten, versiegelten Folientasche entweder im Kühlschrank oder bei Raumtemperatur (2-30ºC/36-86ºF). Der vorliegende Test ist bis zum Ablauf des auf der versiegelten Folientasche aufgedruckten Verfallsdatums stabil. Der Test darf erst unmittelbar vor Gebrauch aus der versiegelten Folientasche entnommen werden. Frieren Sie das vorliegende Produkt nicht ein.
Enthaltenes Material
- Testvorrichtungen
- Gebrauchsanleitung
- Probenahmefläschchen mit Puffer
Benötgtes, nicht enthaltenes Material
- Probenehmebehälter
- Einweghandschuhe
- Kurzzeitmesser
Probenahme und Vorbereitung
Nehmen Sie eine ausreichende Menge Fäces-Probe (1-2 g oder ml bei flüssigen Proben). Die Probenahme von Stuhlproben sollte dabei unter Verwendung sauberer und trockener Behälter erfolgen. (Verwenden Sie keine Konservierungsmittel oder Transportmedien.). Bis zur Testdurchführung kann eine Lagerung der Proben für eine Dauer von 1-2 Tagen im Kühlschrank (2-8ºC/36-46.4ºF) erfolgen. Für eine längere Lagerdauer (maximal 1 Jahr) müssen die Proben bei –20ºC/4ºF eingefroren gelagert werden.
Gefrorene Proben müssen vor der Testdurchführung vollständig aufgetaut, auf Raumtemperatur erwärmt und so gründlich wie möglich gemischt werden.
Verfahren
Bearbeitung der Stuhlproben (siehe Abbildung 1):
Verwenden Sie für jede Probe ein eigenes Probenahmefläschchen. Schrauben Sie den Deckel des Fläschchens ab und stecken Sie den Probenahmestab viermal in die Fäces-Probe, um die Probe aufzunehmen (ungefähr 125 mg). Verschließen Sie das Röhrchen mit dem Puffer und der Stuhlprobe. Schütteln Sie das Fläschchen, um eine gute Durchmischung der Probe zu gewährleisten. Nehmen Sie bei der Verwendung flüssiger Stuhlproben die Probe mit Hilfe einer Pipette auf. Pipettieren Sie 125 µl in das Probenahmefläschchen mit dem Puffer.
Testverfahren (siehe Abbildung 2):
Warten Sie mit der Testdurchführung, bis die Testvorrichtungen, die Stuhlproben und der Puffer Raumtemperatur erreicht haben (15-30ºC/59-86ºF). Öffnen Sie die Folientasche erst unmittelbar vor der Testdurchführung.
- Entnehmen Sie die Campylobacter-Testvorrichtung aus der versiegelten Folientasche und verwenden Sie die Testvorrichtung so bald wie möglich.
- Schütteln Sie das Probenahmefläschchen, um eine gute Durchmischung der Probe zu gewährleisten. Brechen Sie die Spitze des Fläschchens ab.
- Verwenden Sie für jede Probe eine eigene Testvorrichtung. Geben Sie genau 4 Tropfen in den Probennapf (S). Starten Sie den Kurzzeitmesser.
- Lesen Sie das Ergebnis 10 Minuten nach der Zugabe der Probe ab.
Abbildung 1
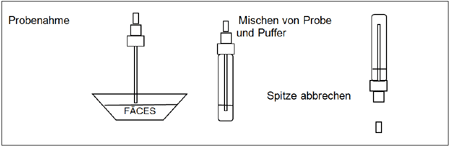
Abbildung 2

Ergebnisauswertung
Abbildung 3
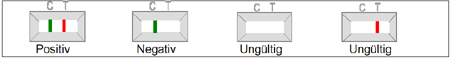
POSITIV: Im zentralen Fenster der Testvorrichtung erscheinen zwei Linien, eine rote Testlinie gekennzeichnet mit dem Buchstaben T und eine grüne Kontrolllinie, gekennzeichnet mit dem Buchstaben C.
NEGATIV: Nur eine grüne Linie erscheint im Kontrollbereich, der mit dem Buchstaben C gekennzeichnet ist. (Kontrolllinie).
UNGÜLTIG: Ein vollständiges Fehlen der grün gefärbten Kontrolllinie, unabhängig vom Auftreten oder Fehlen der roten Testlinie. Hinweis: Die Hauptursache für das Fehlen der Kontrollbande ist ein unzureichendes Probenvolumen, eine inkorrekte Testdurchführung oder die Verwendung unbrauchbarer, verdorbener Reagenzien. Überprüfen Sie das Testverfahren und wiederholen Sie den Test unter Verwendung einer neuen Testvorrichtung. Tritt das Problem weiterhin auf, dann verwenden Sie das Test-Kit nicht mehr und kontaktieren Sie Ihren lokalen Vertriebshändler.
Hinweise zur Ergebnisauswertung
Die Intensität der roten Testlinie im Bereich der Ergebnislinie (T) variiert in Abhängigkeit von der Konzentration der Antigene in der Probe. Unter Verwendung des vorliegenden qualitativen Tests können jedoch weder der quantitative Wert noch die Steigerungsrate der Antigenkonzentration bestimmt werden.
Qualitätskontrolle
Der vorliegende Test beinhaltet interne Verfahrenskontrollen:
– Im Bereich der Kontrollbande (C) erscheint eine grüne Bande. Sie zeigt an, dass ein ausreichendes Probevolumen verwendet und der Test korrekt durchgeführt worden ist.
Einschränkungen
- Der Campylobacter-Test zeigt nur das Vorhandensein von Campylobacter in Proben an (qualitativer Nachweis) und sollte nur für den Nachweis von Campylocacter-Antigenen in Stuhlproben verwendet werden. Weder der quantitative Wert noch die Steigerungsrate der Campylobacter-Antigenkonzentration kann mit diesem Test bestimmt werden.
- Ein Probenüberschuss kann falsche Ergebnisse zur Folge haben. (Es treten braune Banden auf.). Verdünnen Sie die Probe unter Verwendung des Puffers und wiederholen Sie den Test.
- Einige Stuhlproben können eine Verringerung der Intensität der Kontrollbande zur Folge haben.
- Ein wiederholtes Einfrieren und Auftauen der Proben wird nicht empfohlen und kann falsche Ergebnisse zur Folge haben.
- Wenn das Testergebnis negativ ist und die klinischen Symptome fortbestehen, werden weitere Teste empfohlen, die andere klinische Methoden nutzen. Ein negatives Ergebnis schließt nicht in jedem Falle die Möglichkeit einer Campylocacter-Infektion aus.
- Der vorliegende Test bietet eine präsumtive Diagnose einer Campylobacteriose. Die Bestätigung der Diagnose einer Infektion sollte nur durch einen Arzt nach Auswertung aller klinischen Befunde und Laborbefunde erfolgen Die bestätigte Diagnose muss auf der Korrelation der Ergebnisse mit weiteren klinischen Beobachtungen basieren.
Erwartungswerte
Bakterien der Gattung Campylobacter (Campylobacter
spp.) sind eine Hauptursache von Durchfallerkrankungen beim Menschen und gelten allgemein als die weltweit häufigsten Erreger von Gastroenteritis. In Industrienationen und Entwicklungsländern verursachen Campylobacter-Bakterien mehr Fälle von Diarrhöe als beispielsweise durch Lebensmittel übertragene Salmonella-Bakterien. In Entwicklungsländern treten Campylobacter-Infektionen in Kindern unter zwei Jahren mit besonderer Häufigkeit auf und führen in einigen Fällen zum Tod. In fast allen Industrienationen ist die Inzidenz humaner Campylobacter-Infektionen im Laufe der letzten Jahre stetig angestiegen. Die Gründe hierfür sind unbekannt.
Leistungsmerkmale
Sensitivität und Spezifität
Unter Verwendung des Campylobacter-Tests wurde eine Evaluation mit Proben von Patienten durchgeführt, die Symptone wie bei einer Campylobacter-Infektion aufwiesen. Die Evaluation des Campylobacter-Tests erfolgte im Vergleich mit einem anderen immunchromatograohischen Test (ImmunoCard STAT! CAMPY, Meridian Bioscience).
Sensitivität: >99% und Spezifität 98%.
Kreuzreaktivität
Zur Bestimmung der Kreuzreaktivität des Campylobacter-Tests wurde eine Auswertung durchgeführt. Es besteht keine Kreuzreaktivität mit verbreiteten Darmkeimen oder mit anderen in Fäces gelegentlich vorliegenden Organismen und Substanzen:
• Escherichia coli O157:H7
• Helicobacter pylori
• Listeria monocytogenes
• Salmonella
• Shigella
• Staphylococcus aureus
• Yersinia enterocolitica
Literatur
-
Kawatsu, K. et al. „Development and Evaluation of Immunochromatographic Assay for Simple and Rapid Detection of Campylobacter jejuni and Campylobacter coli in Human Stool Specimens“. Journal of Clinical Microbiology Apr. 2008 Vol 46, No. 4, p. 1226-1231.
- Fernández, H. and Farace, M.I. „Manual de Procedimientos Campylobacter“. INEI. 2003.
Qualitätssicherung und Vorkommnisse
Sollten Sie den Eindruck eines Qualitätsmangels haben oder unklare oder ihrerseits falsch-positive oder falsch-negative Ergebnisse erhalten, bitten wir Sie, die betreffende Patientenprobe zurückzustellen und für einen Abruf für uns bereitzuhalten.
Bitte informieren Sie uns umgehend. Sie helfen uns dadurch die Sicherheit der Produkte und damit die Qualität zu gewährleisten.
 |
Hersteller: |

Günter Keul GmbH
Von-Langen-Weg 10
D-48565 Steinfurt
Tel.: 02551/2097 Fax.: 02551/80883
Web: www.keul.de
|
akt. 08.01.2016
|