| |
Keul-o-test
PSA K
KGST183
Qualitativer PSA-Kassettentest für Vollblut, Serum- oder Plasma
Bitte lesen Sie vor dem Gebrauch sorgfältig die Gebrauchsanleitung!
VERWENDUNGSZWECK
Der Keul-o-test PSA K basiert auf einem immunchromatographischen Assay. Der Test dient zum Nachweis von humanem PSA in Serum-, Plasma- oder Vollblutproben und ist zum Gebrauch in der In vitro-Diagnostik bestimmt.
ZUSAMMENFASSUNG UND ERLÄUTERUNG
Bei dem Prostataspezifischen Antigen (PSA) handelt es sich ein ausschließlich von der Prostata synthetisiertes, intrazelluläres Glykoprotein (34KDa). PSA ist ein normaler Bestandteil des Prostatagewebes. Es kommt auch in benignen Prostatahyperplasien und malignem Prostatagewebe, in metastasierenden Prostatakarzinomen sowie in Prostataflüssigkeit und Spermaplasma vor. Es wird jedoch nicht in Lungen-, Darm-, Brust-, Rektum-, Pankreas-, Magen- oder Schilddrüsenkarzinomen nachgewiesen.
Da es mit zunehmendem Alter zu einer Vergrößerung der Prostata kommt, erhöht sich im Regelfall die Menge von PSA im Blut. Allerdings beträgt die normale Gesamtkonzentration von PSA bei 40-50jährigen Männern weniger als 2.5 ng/ml. Im Blut von Patienten mit Prostatakrebs ist die PSA-Konzentration erhöht. Der Vorhersagewert eines PSA-Tests übertrifft den prognostischen Wert einer ausschließlich rektalen oder Ultraschall-Untersuchung. Da erhöhte PSA-Konzentrationen auch bei Vorliegen von BPH (Benigne Prostatahyperplasie) sowie anderen inflammatorischen Erkrankungen des Urogenitalgewebes auftreten, wird die Bestimmung der Blutkonzentration von PSA als ausschließliches Testverfahren für eine Diagnose von Krebs nicht empfohlen. Die Verwendung des PSA-Tests in Kombination mit einer Ultraschalluntersuchung stellt jedoch zum Nachweis von Prostatakrebs eine bessere Methode als ausschließlich eine rektale oder Ultraschalluntersuchung dar.
Der PSA-Test dient zum effektiven Screening von Männern auf Prostatakrebs oder für ein Monitoring der Entwicklung der Erkrankung und des Therapieerfolgs.
TESTPRINZIP
Beim Keul-o-test PSA K handelt es sich um einen immunchromatographischen Assay. Bei Zugabe einer Probe zum Probenfeld migriert die Probe durch das Konjugat-Feld und führt zu einer Mobilisierung des auf das Konjugat-Feld aufgebrachten Gold-Anti-PSA-Konjugats. Das Gemisch bewegt sich durch den Kapillareffekt entlang der Membran und reagiert mit dem in der Testregion aufgebrachten Anti-PSA-Antikörper. Liegt in der Probe PSA in Konzentrationen von 4.0 ng/ml oder höher vor, erscheint in der Testregion eine Farbbande. Liegt PSA nicht oder in einer niedrigeren Konzentration in der Probe vor, bleibt die Testregion farblos. Im weiteren Verlauf migriert die Probe in die Kontrollregion und führt dort zur Ausbildung einer Farbbande. Die Ausbildung einer Farbbande in der Kontrollregion zeigt an, dass der Test funktioniert und das Ergebnis eindeutig ist.
INHALT
-
Testkassetten
-
Einweg-Pipetten
-
Gebrauchsanleitung
ZUSAMMENSETZUNG
Maus-Anti-PSA monoklonaler Antikörper 1 —————0.134±0.05㎍
Maus-Anti-PSA monoklonaler Antikörper 2 —————0.256±0.05㎍
Anti-Maus Immunglobulin G ———————————-0.256±0.05㎍
LAGERUNG UND HALTBARKEITSDAUER
- Lagern Sie die in einer versiegelten Folientasche verpackte Testvorrichtung bei 1 bis 30°C (34-86°F). Frieren Sie den Keul-o-test PSA K nicht ein.
- Haltbarkeitsdauer : bis angegebenes Verfallsdatum.
VORSICHTSMASSNAHMEN
- Ausschließlich zum Gebrauch in der In vitro-Diagnostik.
- Verwenden Sie die Testvorrichtung nicht nach Ablauf des Verfallsdatums.
- Handhaben Sie sämtliche Proben entsprechend potentiell infektiösem Material.
PROBENAHME UND -VORBEREITUNG
- Als Proben können Serum, Plasma oder Vollblut verwendet werden. Die Probenahme sollte unter Standardlaborbedingungen erfolgen.
- Probenahmeverfahren für Vollblut oder Plasma:
Führen Sie die Blutprobenahme unter Verwendung eines Röhrchens mit Antikoagulans wie beispielsweise Heparin oder EDTA durch. Zentrifugieren Sie das Blut zur Gewinnung der Plasmaprobe.
- Probenahmeverfahren für Serum :
Führen Sie die Blutprobenahme unter Verwendung eines Röhrchens ohne Antikoagulans durch. Lassen Sie die Gerinnung ablaufen.
- Es wird empfohlen, frische Proben so bald wie möglich zu verwenden. Vollblutproben sollten innerhalb von 3 Stunden nach der Probenahme getestet werden. Ist eine Lagerung der Proben erforderlich, sollten die roten Blutzellen entfernt werden. Plasma- oder Serumproben können bei 2-8°C 24 Stunden lang gekühlt gelagert werden. Ist eine Lagerung von Plasma- oder Serumproben für mehr als 24 Stunden erforderlich, sollten die Proben bei -20°C oder darunter eingefroren werden.
- Eine Hitzeinaktivierung von Proben kann eine Hämolyse und Proteindenaturierung zur Folge haben und sollte vermieden werden.
TESTVERFAHREN
-
Erwärmen Sie alle Materialien und Proben auf Raumtemperatur. Öffnen Sie anschließend die Folientasche und legen Sie die Testvorrichtung auf eine saubere, trockene und ebene Arbeitsfläche.
Hinweis: Nach dem Öffnen der Folientasche sollte die Testvorrichtung so bald wie möglich verwendet werden.
-
Beschriften Sie die Testvorrichtung mit der Probenkennung.
-
Applizieren Sie mit einer Einweg-Pipette 100 µl (ca. 3 hängende Tropfen) der Probe in die Probenöffnung S der Testkassette.
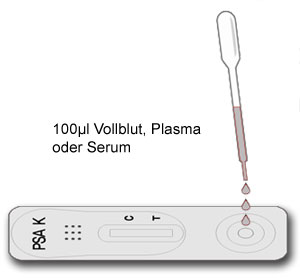
Hinweis: Verwenden Sie zur Vermeidung von Kreuzkontaminationen für jede Probe eine frische Pipette oder Pipettenspitze.
-
Lesen Sie die Ergebnisse nach einer Wartezeit von 10 Minuten ab.
Nehmen Sie nach 15 Minuten keine Auswertung der Testergebnisse mehr vor.
ERGEBNISAUSWERTUNG
-
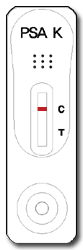
Negativ
Wird in der Testregion (T) keine Farblinie ausgebildet, und wird in der Kontrollregion (C) eine Farblinie ausgebildet, ist das Testergebnis negativ.
-
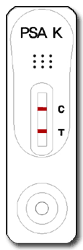
Positiv
Wird sowohl in der Testregion (T) als auch in der Kontrollregion (C) eine Farblinie ausgebildet, ist das Testergebnis positiv. Das Testergebnis kann abgelesen werden, sobald eine distinkte Farblinie in der Testregion auftritt.
-
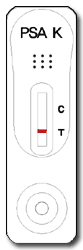
Ungültig
Erscheint keine rote Linie in der Kontrollregion (C), ist das Testergebnis ungültig. Ursache eines ungültigen Ergebnisses kann eine Beeinträchtigung der Testvorrichtung oder ein nicht ordnungsgemäßes Testverfahren sein. Wiederholen Sie den Test unter Verwendung einer neuen Testvorrichtung.
QUALITÄTSKONTROLLE
Bei der Kontrollbande handelt es sich um eine interne Kontrolle der Testreagenzien und des Verfahrens. Die Kontrollbande erscheint, wenn der Test ordnungsgemäß durchgeführt wurde und die Reagenzien reaktionsfähig sind.
Der 1. Internationale Standard (NIBSC-Code 96/670) kann als ein Referenzstandard verwendet werden.
TESTEINSCHRÄNKUNGEN
- Proben, deren Testergebnisse bei Verwendung von Keul-o-test PSA K positiv sind, sollten einem spezifischeren Nachweisverfahren unterzogen werden.
- Vor einer endgültigen Diagnose sollte des Weiteren eine klinische Evaluation der Patientensituation und Krankengeschichte erfolgen.
- Auch bei Vorliegen von Antigen ist die ausschließliche Verwendung eines Schnelltests nicht ausreichend für eine Diagnose von Prostatakrebs. Ebenfalls schließt ein negatives Ergebnis zu keinem Zeitpunkt die Möglichkeit einer Krebserkrankung der Prostata aus.
ERWARTETE WERTE
Keul-o-test PSA K wurde für einen positiven Nachweis von PSA-Konzentrationen von 4.0 ng/ml oder höher entwickelt.
PERFORMANZMERKMALE
- Analytische Sensitivität
Der Keul-o-test PSA K kann PSA einer Konzentration von 4.0 ng/ml oder höher nachweisen.
- Klinische Genauigkeit
Unter Verwendung einer Gesamtzahl von 1.224 klinischen Proben wurde eine klinische Evaluation durchgeführt. Der Keul-o-test PSA K wurde auf Vollblut-, Plasma- und Serumproben-Matrices getestet. Bei sämtlichen Proben-Matrices wurden keine wider-sprechenden Ergebnisse erhalten. Die Serum-/Plasmaproben der Testpersonen wurden auch unter Verwendung eines lizenzierten Enzym-Immunassays (CanAg EIA-Test und ADVIA Centaur CP) getestet.1) Serum-Test
|
Keul-o-test PSA K
|
Quantitativer Assay
|
Gesamt
|
|
Positiv (≥4.0 ng/ml PSA)
|
Negativ (<4.0 ng/ml PSA)
|
|
Positiv
|
58
|
3
|
61
|
|
Negativ
|
0
|
105
|
105
|
|
Gesamt
|
58
|
108
|
166
|
Relative Sensitivität: > 99% (58/58)
Relative Spezifität: 97.2% (105/108)
Gesamtgenauigkeit: 98.2% (163/166)
2) Plasma-Test
|
Keul-o-test PSA K
|
Quantitativer Assay
|
Gesamt
|
|
Positiv (≥4.0 ng/ml PSA)
|
Negativ (<4.0 ng/ml PSA)
|
|
Positiv
|
23
|
25
|
48
|
|
Negativ
|
0
|
481
|
481
|
|
Gesamt
|
23
|
506
|
529
|
Relative Sensitivität: > 99% (23/23)
Relative Spezifität: 95.1% (481/506)
Gesamtgenauigkeit: 95.3% (504/529)
3) Vollblut-Test
|
Keul-o-test PSA K
|
Quantitativer Assay
|
Gesamt
|
|
Positiv (≥4.0 ng/ml PSA)
|
Negativ (<4.0 ng/ml PSA)
|
|
Positiv
|
23
|
21
|
44
|
|
Negativ
|
0
|
485
|
485
|
|
Gesamt
|
23
|
506
|
529
|
Relative Sensitivität: > 99% (23/23)
Relative Spezifität: 95.8% (485/506)
Gesamtgenauigkeit: 96.0% (508/529)
INTERFERIERENDE SUBSTANZEN
Die nachfolgend aufgeführten Substanzen interferieren nicht mit den Testergebnissen von Keul-o-test PSA K.
- Bilirubin (20 mg/dl)
- Heparin (6 IU/dl)
- Humanes Albumin (20,000 mg/dl)
- Triglyceride (1,250 mg/dl)
|
- EDTA (800 mg/dl)
- Hämoglobin (250 mg/dl)
- Natriumcitrat (500 mg/dl)
|
LITERATUR
- Reiter RE et al., Prostate stem cell antigen : A cell surface marker overexpressed in prostate cancer. Proc Natl Acad Sci U S A. 1998, 95(4):1735~1740.
- Haut MJ et al., Progressing prostate carcinoma.The oncologist. 2001, 6(2):183~196.
- Woolf SH et al., Screening for prostate cancer with prostate-specific antigen. An examination of the evidence. N Engl J Med. 1995, 333(21):1401~1405.
CE0123: Das vorliegende Produkt erfüllt die Anforderungen der Richtlinie 98/79/EC für Medizinprodukte für die In vitro-Diagnostik.
Abrechnung
| |
Nr. |
Preis in € |
GOÄ
inkl. Befundmitteilung |
3908A |
17,90 |
Qualitätssicherung und Vorkommnisse
Sollten Sie den Eindruck eines Qualitätsmangels haben oder unklare oder ihrerseits falsch-positive oder falsch-negative Ergebnisse erhalten, bitten wir Sie, die betreffende Patientenprobe zurückzustellen und für einen Abruf für uns bereitzuhalten.
Bitte informieren Sie uns umgehend. Sie helfen uns dadurch die Sicherheit der Produkte und damit die Qualität zu gewährleisten.
 0123 0123 |
Hersteller: |

Humasis Co., Ltd.,
Rm. 114, 502, 504, 604, 604-1, B03-1, B03-2, 88,
Jeonpa-ro, Dongan-gu, Anyang-si, Gyeonggi-do, Republic of Korea |
akt. 24.03.2017
|
|