Keul-o-test®
Shigella
KGST311
Ein schneller Ein-Schritt-Test für den qualitativen Nachweis von Shigella spp. in Fäces. Nur für den professionellen Gebrauch in der In vitro-Diagnostik.
Verwendungszweck
Der Shigella-Test ist ein immunchromatographischer, farbiger Ein-Schritt-Test für den qualitativen Nachweis von Shigella spp. in Stuhlproben. Der Test dient zum Nachweis von Shigellose bei infizierten Personen.
Zusammenfassung
Shigella-Infektionen des Menschen erfolgen durch Bakterien der Shigella-Spezies S. dysenteriae, S. flexneri, S. boydii sowie S. sonnei. Eine Infektion verursacht verschiedene klinische Syndrome, einschließlich Durchfallerkrankungen, Fieber und Magenkrämpfen. Als auslösende Faktoren von Shigellose-Erkrankungen gelten mangelhafte sanitäre Verhältnisse, kontaminierte Nahrungsmittel und kontaminiertes Trinkwasser sowie eine beengte räumliche Verhältnisse. Die Krankheitsdauer beträgt bei Shigellose im Regelfall 5 bis 7 Tage. Die häufigsten Shigella-Serogruppen sind besonders weit verbreitet. Unter schlechten hygienischen Bedingungen führt Shigella immer wieder zu Problemen und kann unter Umständen ganze Bevölkerungsgruppen infizieren.
Der vorliegende Shigella-Test ermöglicht einen raschen Nachweis von Shigella spp. direkt aus Fäces-Proben.
Prinzip
Der Shigella-Test ist ein qualitativer Immunassay für den Nachweis von Shigella in Fäces-Proben. Zur Erkennung von Shigella-Antigen ist die Membran der Testvorrichtung im Bereich der Testbande mit Antikörpern vorbeschichtet. Während der Testdurchführung reagiert die Probe mit den farbigen Latex-Partikeln, die auf dem Teststreifen aufgetrocknet sind. Diese farbigen Latex-Partikel sind mit anti-Shigella-Antikörpern beschichtet. Die Mischung aus Probe und Farbpartikeln wandert durch Kapillarwirkung entlang der Membran. Bei einem positiven Ergebnis „fangen“ die spezifischen Antikörper auf der Membran das entstandene farbige Konjugat ein und bilden im Bereich der Testbande eine farbige Bande. Die Mischung wandert weiter entlang der Membran zu der Position der Kontrollbande, an der sich immobilisierter Antikörper befindet. Unabhängig vom Testergebnis erscheint im Bereich der Kontrollbande immer eine GRÜNE Farbbande. Das Erscheinen dieser grünen Bande dient als ein Nachweis, dass ein ausreichendes Volumen pipettiert wurde, die Mischung korrekt gewandert ist sowie als interne Kontrollen für die Reagenzien.
Vorsichtsmaßnahmen
- Nur für den professionellen Gebrauch in der In vitro-Diagnostik.
- Verwenden Sie das Produkt nach Ablauf des Verfallsdatums nicht mehr.
- Der Test sollte erst unmittelbar vor der Verwendung aus der Folientasche entnommen werden.
- Verwenden Sie den Test nicht, wenn die Folientasche beschädigt ist.
- Befolgen Sie die Grundsätzen Guter Laborpraxis. Tragen Sie Schutzkleidung und verwenden Sie Einweghandschuhe, Essen, trinken oder rauchen Sie nicht am Arbeitsplatz.
- Alle Proben sollte als mögliche Risikostoffe eingestuft und entsprechend infektiösem Material (Krankheitserregern) behandelt werden.
- Nach der Testdurchführung sollte die Testvorrichtung in einem geeigneten Behälter für biologische Risikostoffe entsorgt werden.
- Die Testdurchführung muss innerhalb von 2 Stunden nach dem Öffnen der versiegelten Folientasche erfolgen.
Lagerung und Stabilität
Lagern Sie das Produkt in der ungeöffneten, versiegelten Folientasche entweder im Kühlschrank oder bei Raumtemperatur (2-30ºC/36-86ºF). Der vorliegende Test ist bis zum Ablauf des auf der versiegelten Folientasche aufgedruckten Verfallsdatums stabil. Der Test darf erst unmittelbar vor Gebrauch aus der versiegelten Folientasche entnommen werden. Frieren Sie das vorliegende Produkt nicht ein.
Enthaltenes Material
- Shigella-Testvorrichtung
- Gebrauchsanleitung
- Probenahmefläschchen mit Puffer
Benötigtes, nicht enthaltenes Material
- Probenahmebehälter
- Einweghandschuhe
- Kurzzeitmesser
Probenahme und Vorbereitung
Nehmen Sie eine ausreichende Menge Fäces-Probe (1-2 g oder ml bei flüssigen Proben). Die Probenahme von Stuhlproben sollte dabei unter Verwendung sauberer und trockener Behälter erfolgen. (Verwenden Sie keine Konservierungsmittel oder Transportmedien.). Bis zur Testdurchführung kann eine Lagerung der Proben für eine Dauer von 1-2 Tagen im Kühlschrank (2-4ºC/36-40ºF) erfolgen. Für eine längere Lagerdauer müssen die Proben bei -20ºC/4ºF eingefroren gelagert werden. Ein wiederholtes Einfrieren und Auftauen der Proben wird nicht empfohlen. Gefrorene Proben müssen vor der Testdurchführung vollständig aufgetaut, auf Raumtemperatur erwärmt und so gründlich wie möglich gemischt werden.
Verfahren
Bearbeitung der genommenen Stuhlproben (siehe Abbildung 1):
1. Verwenden Sie für jede Probe ein eigenes Probenahmefläschchen. Schrauben Sie den Deckel des Fläschchens ab und stecken Sie den Probenahmestab an verschiedenen Stellen in die Fäces-Probe, um die Probe aufzunehmen (ungefähr 150 mg). Stecken Sie den Probenahmestab mit der Probe in das Fläschchen mit dem Puffer. Schließen Sie das Fläschchen mit dem Puffer und der Stuhlprobe.
2. Schütteln Sie das Fläschchen, um eine gute Durchmischung der Probe zu gewährleisten. Nehmen Sie bei der Verwendung flüssiger Stuhlproben die Probe mit Hilfe einer Pipette auf. Pipettieren Sie ungefähr 150 μl in das Probenahmefläschchen mit dem Puffer.
Testverfahren (siehe Abbildung 2):
Warten Sie mit der Testdurchführung, bis die Testvorrichtungen, die Stuhlproben und der Puffer Raumtemperatur erreicht haben (15-30ºC/59-86ºF). Öffnen Sie die Folientasche erst unmittelbar vor der Testdurchführung.
3. Entnehmen Sie die Shigella-Testvorrichtung aus der versiegelten Folientasche und verwenden Sie die Testvorrichtung so bald wie möglich.
4. Schütteln Sie das Probenahmefläschchen, um eine gute Durchmischung der Probe zu gewährleisten. Brechen Sie die Spitze des Fläschchens ab.
5. Verwenden Sie für jede Probe eine eigene Testvorrichtung. Geben Sie genau 4 Tropfen oder 100 µl in den Probennapf (S). Starten Sie den Kurzzeitmesser.
6. Lesen Sie das Ergebnis 10 Minuten nach der Zugabe der Probe ab.
Abbildung 1
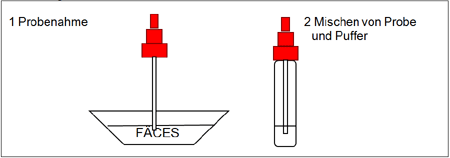
Abbildung 2

Ergebnisauswertung
Abbildung 3

POSITIV: Im zentralen Fenster der Testvorrichtung erscheinen zwei Banden. Im Bereich der Ergebnisbande erscheint eine rote Testbande, die mit dem Buchstaben T gekennzeichnet ist. Im Bereich der Kontrollbande erscheint eine grüne Kontrollbande, die mit dem Buchstaben C gekennzeichnet ist.
NEGATIV: Im Bereich der mit dem Buchstaben C markierten Kontrollbande erscheint nur eine grüne Bande.
UNGÜLTIG: Ein vollständiges Fehlen der grünen Kontrollbande, unabhängig vom Auftreten der roten Testbande. Hinweis: Die Hauptursache für das Fehlen der Kontrollbande ist ein unzureichendes Probenvolumen, eine inkorrekte Testdurchführung oder die Verwendung unbrauchbarer, verdorbener Reagenzien. Überprüfen Sie das Testverfahren und wiederholen Sie den Test unter Verwendung einer neuen Testvorrichtung. Tritt das Problem weiterhin auf, dann verwenden Sie das Test-Kit nicht mehr und kontaktieren Sie Ihren lokalen Vertriebshändler.
Hinweise zur Ergebnisauswertung
Die Intensität der roten Farbbande im Bereich der Ergebnisbande (T) variiert in Abhängigkeit von der Antigenkonzentration in der Probe. Unter Verwendung des vorliegenden qualitativen Tests können jedoch weder der quantitative Wert noch die Steigerungsrate der Antigenkonzentration bestimmt werden.
Qualitätskontrolle
Der vorliegende Test beinhaltet interne Verfahrenskontrollen:
– Im Bereich der Kontrollbande (C) erscheint eine grüne Bande. Sie zeigt an, dass ein ausreichendes Probevolumen verwendet und der Test korrekt durchgeführt worden ist.
– Ein farbloser, klarer Hintergrund stellt eine interne Negativkontrolle dar. Funktioniert der Test korrekt, dann sollte der Hintergrund im Ergebnisbereich klar erscheinen und das Ablesen des Testresultats nicht stören.
Einschränkungen
- Die Testdurchführung muss innerhalb von 2 Stunden nach dem Öffnen der versiegelten Folientasche erfolgen.
- Ein Probenüberschuss (Überschuss von Stuhlprobe) kann falsche Ergebnisse zur Folge haben. (Es treten braune Banden auf.). Verdünnen Sie die Probe unter Verwendung des Puffers und wiederholen Sie den Test.
- Einige Stuhlproben können eine Verringerung der Intensität der grünen Kontrollbande zur Folge haben.
- Ein wiederholtes Einfrieren und Auftauen der Proben kann falsche Ergebnisse zur Folge haben.
- Ein negatives Ergebnis ist nicht aussagekräftig, da die Möglichkeit besteht, dass der Gehalt von Shigella in der Stuhlprobe zu gering ist. Die Bestimmung von Shigella sollte unter Verwendung einer Probe einer Anreicherungskultur erfolgen.
- Der vorliegende Test bietet eine präsumtive Diagnose einer Shigellose. Die Bestätigung der Diagnose einer Infektion sollte nur durch einen Arzt nach Auswertung aller klinischen Befunde und Laborbefunde erfolgen Die bestätigte Diagnose muss auf der Korrelation der Ergebnisse mit weiteren klinischen Beobachtungen basieren.
Erwartungswerte
Jährlich werden in den Vereinigten Staaten von Amerika circa 14 000 Shigellose-Fälle gemeldet. Da viele der schwächer verlaufenden Krankheitsfälle nicht diagnostiziert oder gemeldet werden, ist die tatsächliche Zahl von Infektionen möglicherweise zwanzig Mal so hoch. Die Verbreitung von Shigellose ist in Gebieten mit mangelhafter Hygiene besonders stark. Die Erkrankung kann unter diesen Umständen zu immer wiederkehrenden Problemen führen und in einigen Fällen ganze Bevölkerungsgruppe infizieren. Die Shigellose tritt häufiger im Sommer als im Winter auf.
Leistungsmerkmale
Sensitivität und Spezifität
Unter Verwendung des vorliegenden Shigella-Tests wurde eine Untersuchung durchgeführt. Eine Anzahl von Stuhlproben wurde analysiert und die erhaltenen Ergebnisse wurden mit Hilfe des Culture Shigella Device bestätigt. Die Resultate ergaben sowohl für die Sensitivität als auch für die Spezifität einen Wert von >99%.
Die für die Herstellung des vorliegenden Tests verwendeten Antikörper erkennen sowohl Shigella-Epitope, die in Stuhlproben von Patienten nachgewiesen wurden, als auch Epitope aus In vitro-Bakterienkulturen.
Die dargestellten vorläufigen Werte gelten unter Vorbehalt, bis weitere Daten zur Bewertung zur Verfügung stehen.
Kreuzreaktivität
Es wurde eine Untersuchung zur Bestimmung der Kreuzreaktivität des Shigella-Tests durchgeführt. Es besteht keine Kreuzreaktivität mit verbreiteten Darmkeimen, oder mit anderen in Fäces vorliegenden Organismen und Substanzen: H. pylori, Escherichia coli O157:H7, Listeria monocytogenes, Campylobacterspp., Salmonella spp.
Literatur
-
B Matyas. MD, et al, „Preliminary FoodNet Data on the Incidence of Infection with Pathogens Transmitted Commonly Through Food -10 States, 2009“. MMWR; April 2010, Vol.16. No 14, p.418-422.
- Shah M. Faruque. Et al, “ Shigella dysenteriae Type 1-Specific Bacteriophage from Environmental Waters in Bangladesh“. Applied and Environmental Microbiology, Dec 2003. Vol.69. No 12, p 7028-7031.
Qualitätssicherung und Vorkommnisse
Sollten Sie den Eindruck eines Qualitätsmangels haben oder unklare oder ihrerseits falsch-positive oder falsch-negative Ergebnisse erhalten, bitten wir Sie, die betreffende Patientenprobe zurückzustellen und für einen Abruf für uns bereitzuhalten.
Bitte informieren Sie uns umgehend. Sie helfen uns dadurch die Sicherheit der Produkte und damit die Qualität zu gewährleisten.
 |
Hersteller: |

Günter Keul GmbH
Von-Langen-Weg 10
D-48565 Steinfurt
Tel.: 02551/2097 Fax.: 02551/80883
Web: www.keul.de
|
akt. 30.05.2012
|