| |
Keul-o-test
Rotavirus-Testkassette
für Stuhlproben
Bestellnummer: KGST194
DIMDI-Reg.-Nr.: DE/CA22/1116-186-IVD
Verwendungszweck
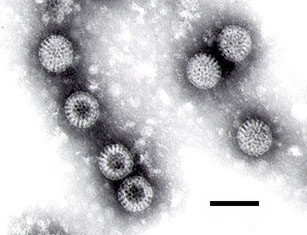
Bei dem Keul-o-test-Rotavirus-Kombinationstest handelt es sich um einen einfachen, immunchromatographischen Assay zum schnellen Nachweis von Rotavirus in Stuhlproben.
Testprinzip
Der Keul-o-test-Rotavirus-Test verwendet eine einzigartige Kombination monoklonaler und polyklonaler Antikörper zum selektiven, hochsensitiven Nachweis von Rotavirus in Proben. Die relative Testsensitivität und -spezifität für Rotavirus beträgt (im Vergleich zum Meridian-Elisa) 100%.
Lagerung und Stabilität
Das Keul-o-test-Rotavirus-Test-Kit sollte bei Raumtemperatur oder 2-30oC (36-86oF) gelagert werden. Die Testvorrichtung ist empfindlich gegenüber Feuchtigkeit und Hitze. Führen Sie den Test unmittelbar nach Entnahme der Testvorrichtung aus der Folientasche durch. Verwenden Sie die Testvorrichtung nicht nach Ablauf des Verfallsdatums.
Warnhinweise
-
Ausschließlich zum Gebrauch in der In vitro-Diagnostik geeignet.
-
Rauchen oder essen Sie nicht bei Umgang mit den Proben.
-
Tragen Sie bei Umgang mit den Proben Schutzhandschuhe. Waschen Sie sich im Anschluss sorgfältig die Hände.
-
Vermeiden Sie ein Verschütten von Proben oder eine Aerosolbildung.
-
Beseitigen Sie durch Proben verursachte Verunreinigungen sorgfältig unter Verwendung eines geeigneten Desinfektionsmittels.
-
Dekontaminieren Sie alle Proben, Reaktions-Kits und potentiell kontaminierter Materialien und entsorgen Sie diese entsprechend infektiösem Abfall in einem Behälter für biologische Risikostoffe.
-
Verwenden Sie das Test-Kit nicht, falls die Folientasche beschädigt oder das Siegel gebrochen ist.
Mitgelieferte Materialien:
- Rotavirus-Test-Kassette
- Extraktionsröhrchen
- Gebrauchsanleitung
Probenahme
- Für diesen Assay sollten ausschließlich Stuhlproben verwendet werden. Diese können von Toilettenpapier genommen oder unter Verwendung eines sauberen Behälters aufgefangen werden. Bei der Probenahme sollte eine Kontamination der Probe mit Wasser aus der Toilette vermieden werden.
- Entfernen Sie die Kappe der Probenahmevorrichtung und verwenden Sie den Kollektorstab zur Entnahme eines Aliquots der Stuhlprobe. Tauchen Sie hierzu den Stab an 3 zufällig ausgewählten, unterschiedlichen Stellen in die Stuhlprobe (Abbildung 1).
- Stecken Sie den Kollektorstab mit der Stuhlprobe wieder in die Probenahmevorrichtung. Setzen Sie die Kappe auf die Vorrichtung und schrauben Sie sie fest. Schütteln Sie die Probenahmevorrichtung gründlich.
- Die entnommene Probe kann bei 2 bis 8°C 3 Tage gelagert werden.
Testdurchführung
- Entnehmen Sie die Testkassette aus der Folientasche und platzieren Sie sie auf einer ebenen, trockenen Arbeitsfläche.
- Wurde die Stuhlprobe gekühlt gelagert, dann erwärmen Sie die Probenahmevorrichtung auf Raumtemperatur. Schütteln Sie die Vorrichtung anschließend mehrfach.
- Halten Sie die Probenahmevorrichtung so, dass die Spitze der Vorrichtung nach oben weist. Brechen Sie nun die Spitze ab und applizieren Sie durch Zusammendrücken der Probenahmevorrichtung 3 hängende Tropfen der extrahierten Probe in die dafür vorgesehene Vertiefung der Testkassette (Abbildung 2).
- Nach Testbeginn bewegt sich eine violette Bande in dem Ergebnisfenster in der Mitte der Testkassette.
- Werten Sie die Testergebnisse nach 9 bis 10 Minuten aus. Nehmen Sie nach 10 Minuten keine Auswertung mehr vor.
Achtung: Die oben angegebene Inkubationszeit basiert auf der Annahme, dass die Testergebnisse bei Raumtemperatur (15 bis 30°C) abgelesen werden. Liegt die Raumtemperatur deutlich unterhalb 15°C, sollte die Inkubationszeit entsprechend verlängert werden.
Testauswertung
- Im linken Bereich des Ergebnisfensters erscheint eine farbige Bande und zeigt an, dass der Test ordnungsgemäß funktioniert. Bei dieser Bande handelt es sich um die Kontrollinie.
- Bei der Detektion von Rotavirus in einer Probe erscheint im Bereich der Testlinie „T“ eine farbige Bande im Ergebnisfenster.
Positives Ergebnis: Das Vorliegen einer farbigen Bande bei „C“ sowie der Testlinie bei „T“ im Ergebnisfenster zeigt (unabhängig von der Reihenfolge des Erscheinens) ein positives Ergebnis an (Abbildung 2).
Negatives Ergebnis: Das Vorliegen von nur einer farbigen Bande bei „C“ im Ergebnisfenster zeigt ein negatives Ergebnis an (Abbildung 3).
Unzulässiges Ergebnis: Erscheint nach Durchführung des Tests keine, oder nur die Testlinie „T“ als farbige Bande innerhalb des Ergebnisfensters, wird das Ergebnis als unzulässig betrachtet. Mögliche Ursachen: Die Gebrauchsanleitung wurde nicht befolgt oder die Qualität des Test-Kits ist beeinträchtigt. Es wird empfohlen, die Probe erneut zu testen (Abbildung 4).
Hinweis: Ein positives Ergebnis ändert sich nach Ablauf der Inkubationszeit (10 Minuten) nicht. Zur Vermeidung nicht korrekter Ergebnisse sollte der Test nach mehr als 10 Minuten jedoch nicht mehr ausgewertet werden.
Einschränkungen des Tests
Wie bei jedem diagnostischen Verfahren sollte der Arzt die durch diesen Test erhaltenen Daten durch andere klinische Methoden verifizieren. Ein negatives Ergebnis schließt eine Infektion nicht aus. Besteht ein begründeter Verdacht auf eine Infektion, sollt eine weitere Stuhlprobe untersucht werden. Ein positives Ergebnis schließt das Vorliegen weiterer Pathogene nicht aus.
Literatur
-
Grauballe PC, Vestergaard BF, Meyling A, Genner J. Optimized enzyme-linked immunosorbent assay for detection of human and bovine rotavirus in stools: comparison with electron-microscopy, immunoelectro-osmophoresis, and fluorescent antibody techniques. J Med Virol 1981; 7 : 29-40.
-
Flewett TH, Arias CF, Avendano LF, Ghafoor A, Mathan MM, Mendis L, et al. Comparative evaluation of the WHO and DAKOPATTS enzyme-linked immunoassay kits for rotavirus detection. Bull World Health Organ 1989; 67: 369-74.
-
Kelkar SD. Development of indigenous ELISA for rotavirus diagnosis and its comparison with commercial kit. Indian J Med Res 1993; 97 : 93-101.
-
Kok TW, Burrell CJ. Comparison of five enzyme immunoassays, electron microscopy, and latex agglutination for detection of rotavirus in fecal specimens. J Clin Microbiol 1989; 27: 364-6.
-
Lowry OH, Rosebrough NJ, Farr AL, Randall RJ. Protein measurement with the folin-phenol reagent. JBiolChem 1951; 193 : 265-75.
-
Wilson MB, Nakano PK. Recent developments in the periodate method of conjugating horse radish peroxidase (HRP) to antibodies. In: Knapp W, Holubar K, Wides G, editors. Immune/fluorescent and related staining techniques. Amsterdam: Elsevier/North-Holland Biomedical Press; 1978 p. 215.
Qualitätssicherung und Vorkommnisse
Sollten Sie den Eindruck eines Qualitätsmangels haben oder unklare oder ihrerseits falsch-positive oder falsch-negative Ergebnisse erhalten, bitten wir Sie, die betreffende Patientenprobe zurückzustellen und für einen Abruf für uns bereitzuhalten.
Bitte informieren Sie uns umgehend. Sie helfen uns dadurch die Sicherheit der Produkte und damit die Qualität zu gewährleisten.
 |
Hersteller: |

Günter Keul GmbH
Von-Langen-Weg 10
D-48565 Steinfurt
Tel.: 02551/2097 Fax.: 02551/80883
Web: www.keul.de
|
|
|