| |
Keul-o-test®
Rota-Adenovirus-Combo-Testkassette
für Stuhlproben
KGST195
DIMDI Reg.-Nr.: DE/CA22/1116-190-IVD
Einstufiger Schnelltest für den qualitativen Nachweis von Rotavirus- und Adenovirus-Anti-genen in menschlichem Stuhl. Nur für die professionelle In-vitro-Diagnostik.
VERWENDUNGSZWECK
Der Rotavirus-Adenovirus Test ist ein schneller chromatographischer Immunoassay für den qualitativen Nachweis von Rotavirus- und Adenovirus-Antigenen in menschlichen Stuhlproben als Hilfsmittel bei der Diagnose einer Rotavirus- bzw. einer Adenovirus-Infektion.
ZUSAMMENFASSUNG
Virale Gastroenteritis ist eine Infektion, die von einer Vielzahl von Viren hervorgerufen wird und zu Erbrechen und Durchfall führt. Unter den vielen verschiedenen Viren, die eine Gastroenteritis hervorrufen können, sind Rotaviren, Noroviren, Adenoviren, Sapovi-ren und Astroviren. Die Hauptsymptome der viralen Gastroenteritis sind wässriger Durch-fall und Erbrechen. Die betroffene Person kann auch unter Kopfschmerzen, Fieber sowie Unterleibskrämpfen („Magenschmerzen“) leiden. Im Allgemeinen treten die Symptome 1 bis 2 Tage nach der Infektion mit einem Virus, der Gastroenteritis auslöst, auf und dauern in Abhängigkeit vom Virustyp 1 bis 10 Tage an. Einige Studien haben gezeigt, dass die Dauer der Symptome durchschnittlich 3 bis 4 Tage beträgt. Rotaviren sind die häuf gere Ursache für akuten Durchfall bei Kindern unter zwei Jahren. Adenoviren und Astroviren führen meistens bei jüngeren Kindern zu Durchfall, ältere Kinder und Erwachsene können jedoch auch betroffen sein.
ARBEITSWEISE
Virale Gastroenteritis ist eine Infektion, die von einer Vielzahl von Viren hervorgerufen wird und zu Erbrechen und Durchfall führt. Unter den vielen verschiedenen Viren, die eine Gastroenteritis hervorrufen können, sind Rotaviren, Noroviren, Adenoviren, Sapovi-ren und Astroviren. Die Hauptsymptome der viralen Gastroenteritis sind wässriger Durchfall und Erbrechen. Die betroffene Person kann auch unter Kopfschmerzen, Fieber sowie Unterleibskrämpfen („Magenschmerzen“) leiden. Im Allgemeinen treten die Symptome 1 bis 2 Tage nach der Infektion mit einem Virus, der Gastroenteritis auslöst, auf und dauern in Abhängigkeit vom Virustyp 1 bis 10 Tage an. Einige Studien haben gezeigt, dass die Dauer der Symptome durchschnittlich 3 bis 4 Tage beträgt. Rotaviren sind die häufigere Ursache für akuten Durchfall bei Kindern unter zwei Jahren. Adenoviren und Astroviren führen meistens bei jüngeren Kindern zu Durchfall, ältere Kinder und Erwachsene können jedoch auch betroffen sein.
REAGENZIEN
Der Test enthält mit Anti-Rotavirus-Antikörpern und Anti-Adenovirus-Antikörpern beschichtete Partikel und eine mit Anti-Rotavirus-Antikörpern und Anti-Adenovirus-Antikörpern beschichtete Membrane.
VORSICHTSMASSNAHMEN
- Nur für die professionelle In-vitro-Diagnostik.
- Nicht nach Ablauf des Verfallsdatums verwenden.
- Die Testkassette sollte bis zum Gebrauch im versiegelten Beutel verbleiben.
- Nicht bei beschädigtem Beutel verwenden.
- Folgen Sie den Regeln guter Laborpraxis: Tragen Sie Schutzkleidung, verwenden Sie Einweghandschuhe. Essen, trinken bzw. rauchen Sie nicht bei der Versuchs-durchführung.
- Alle Proben sollten als potentiell gefährlich eingestuft und als infektiös behandelt werden.
- Der Test sollte nach der Verwendung in einem Abfallbehälter für biogefährdenden Müll entsorgt werden.
- Der Test ist innerhalb von 2 Stunden nach Öffnen des versiegelten Beutels durchzuführen.
LAGERUNG UND STABILITÄT
In der versiegelten Verpackung entweder gekühlt oder bei Zimmertemperatur lagern (2-30°C/36-86°F). Der Test ist bis zum Verfallsdatum, das auf dem versiegelten Beutel aufgedruckt ist, verwendbar. Die Testkassette muss bis zum Gebrauch im versiegelten Beutel verbleiben. Nicht einfrieren.
PROBENNAHME UND VORBEREITUNG
- Der Virale Nachweis wird verbessert, wenn die Probe beim Einsetzen der Symptome genommen wird. Es wurde berichtet, dass die maximale Ausscheidung von Rotaviren und Adenoviren in Stuhl von Patienten mit Gastroentritis 3 -5 Tage nach dem Einsetzen der Symptome vorkommen. Wenn die Proben lange nach dem Einsetzen der Durchfallsymptome genommen werden, kann die Menge der Antigene nicht dazu ausreichen eine positive Reaktion zu erhalten, oder die nachgewiesenen Antigene können nicht mit der Durchfallerkrankung in Verbindung gebracht werden.
- Die Stuhlprobe muss in einem sauberen, trockenen und wasserdichten Behälter, der kein Reinigungsmittel, Konservierungsmittel oder Transportmedium enthält, gesammelt werden.
- Bringen Sie die notwendigen Reagenzien vor dem Gebrauch auf Raumtemperatur.
MATERIALIEN
vorhandene Materialien
- Testkassetten
- Probenröhrchen mit Extraktionspuffer
- Einwegpipetten
- Gebrauchsanweisung
erforderliche aber nicht vorhandene Materialien
- Probensammelbehälter
- Timer
- Zentrifuge und Pipette um 80 µL zu pipettieren falls erforderlich
GEBRAUCHSANWEISUNG
Erlauben Sie der Testkassette, der Probe und dem Puffer vor dem Testen Raumtemperatur (15 30°C) zu erreichen.
- Stuhlprobenahme:
Sammeln Sie eine ausreichende Menge Stuhl (1-2 ml oder 1-2 g) in einem sauberen, trockenen Probensammelbehälter um genug Viruspartikel zu erhalten. Die besten Ergebnisse werden erzielt, wenn der Test innerhalb von 6 Stunden nach der Probenahme durchgeführt wird. Sofern nicht innerhalb von 6 Stunden getestet wird, können gesammelte Proben für 3 Tage bei 2-8°C gelagert werden. Für eine längere Lagerung sollten die Proben bei unter -20 °C aufbewahrt werden.
- Vorbereitung der Stuhlproben:
• Für feste Proben:
Schrauben Sie die Kappe des Probenahmeröhrchens ab, stechen Sie den Probenapplikator an wenigstens 3 unterschiedlichen Stellen zufällig in die Stuhlprobe, um etwa 50 mg Stuhl (entspricht ¼ einer Erbse) zu sammeln. Versuchen Sie keine größere Menge der Stuhlprobe zu gewinnen.
• Für flüssige Proben:
Halten Sie die Pipette senkrecht, saugen Sie die Stuhlprobe auf und geben Sie dann 2 Tropfen der flüssigen Probe (etwa 50 µL) in das Probenahmeröhrchen mit dem Extraktionspuffer. Setzen Sie die Kappe auf das Probenahmeröhrchen und schütteln das Probenahmeröhrchen kräftig, um die Probe und den Extraktionspuffer zu mischen. Lassen Sie das Sammelröhrchen zum Reagieren für 2 Minuten ruhen.
- Bringen Sie den Beutel auf Raumtemperatur, bevor Sie Ihn öffnen. Entnehmen Sie die Testkassette aus dem Folienbeutel und verwenden Sie sie innerhalb von einer Stunde. Die besten Ergebnisse werden erhalten, wenn der Test unverzüglich nach dem Öffnen des Folienbeutels durchgeführt wird.
- Halten Sie das Probenahmeröhrchen aufrecht und öffnen Sie die Kappe an der Spitze. Drehen Sie das Probenahmeröhrchen um und geben Sie langsam 2 volle, hängende Tropfen der extrahierten Probe (etwa 80μL) in die Probenvertiefung (S) der Testkassette. Warten Sie mit dem Hinzufügen des zweiten Tropfens bis der erste vollständig aufgenommen wurde. Starten Sie dann den Kurzzeitwecker. Vermeiden Sie den Einschluss von Luftblasen in der Probenvertiefung (S). Beachten Sie die Abbildung unten.
- Lesen Sie die Ergebnisse nach 10 Minuten nach der Hinzugabe der Probe ab. Lesen Sie die Ergebnisse nicht nach mehr als 20 Minuten ab.
HINWEIS: Wenn die Probe nicht wandert (Vorhandensein von Partikeln), dann zentrifugieren Sie die extrahierte Probe im Extraktionspuffer-Röhrchen. Nehmen Sie 80 µL des Überstandes und geben Sie ihn in die Probenvertiefung (S). Starten Sie den Kurzzeitwecker und fahren Sie ab Punkt 5 der obigen Gebrauchsanleitung fort.
AUSWERTUNG DER ERGEBNISSE
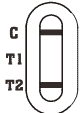 |
POSITIV:
Adenovirus Positiv: * Eine farbige Linie erscheint im Kontrolllinienbereich (C) und eine andere, farbige Linie erscheint im T2-Linienbereich.
|
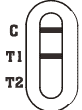 |
Rotavirus Positiv: * Eine farbige Linie erscheint im Kontrolllinienbereich (C) und eine andere, farbige Linie erscheint im T1-Linienbereich. |
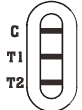 |
Rotavirus und Adenovirus Positiv: * Eine farbige Linie erscheint im Kontrolllinienbereich (C) und zwei andere, farbigen Linien escheinen im T1-Linienbereich und T2-Linienbereich. |
| |
*HINWEIS: Die Farbintensität im Testlinienbereich (T1/T2) schwankt in Abhängigkeit der Konzentration des Vorhandenseins der Rotavirus- oder Adenovirus-Antigene in der Probe. Daher sollte jede Farbschattierung im Testlinienbereich (T1/T2) als positive betrachtet werden. |
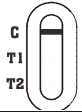 |
NEGATIV: Eine farbige Linie erscheint im Kontrolllinienbereich (C). Keine Linie erscheint im Testlinienbereich (T1/T2). |
 |
UNGÜLTIG: Es erscheint keine Kontrolllinie (C). Eine unzureichende Probemenge oder eine inkorrekte Durchführung sind die wahrscheinlichsten Gründe für das Fehlen der Kontrolllinie. Überprüfen Sie die Durchführung und wiederholen Sie den Test mit einer neuen Testkassette. Wenn das Problem weiterhin besteht, beenden Sie sofort die Verwendung des Testkits und setzen Sie sich mit Ihrem örtlichen Händler in Verbindung. |
QUALITÄTSKONTROLLE
Der Test beinhaltet eine interne Verfahrenskontrolle. Eine farbige Linie, die im Kontrollbereich (C) erscheint, ist als interne positive Verfahrenskontrolle zu betrachten. Sie bestätigt eine ausreichende Probemenge und eine korrekte Handhabung.
Externe Kontrollen sind nicht in diesem Testkit enthalten. Im Rahmen einer guten Laborpraxis wird empfohlen, dass positive und negative Kontrollen untersucht werden, um das Testverfahren zu bestätigen und die ordnungsgemäße Leistungsfähigkeit des Tests zu verifizieren.
BESCHRÄNKUNGEN
- Die Rotavirus- und Adenovirus-Combo-Schnelltestkassette (Stuhl) dient nur dem in-vitro-diagnostischen Gebrauch. Der Test sollte nur zum Nachweis von humanen Rotavirus und Adenovirus in Stuhlproben verwendet werden. Weder ein quantitativer Wert noch ein Anstieg der Konzentration der humanen Rotaviren und Adenoviren können mit diesem qualitativen Test bestimmt werden.
- Die Rotavirus- und Adenovirus-Combo-Schnelltestkassette (Stuhl) zeigt nur das Vorhandensein von Rotaviren und Adenoviren in der Probe an und sollte nicht als alleiniges Kriterium für einen durch konforme Rotaviren und Adenoviren als Erreger verursachten Durchfall verwendet werden
- Wie bei allen diagnostischen Tests, müssen alle Ergebnisse zusammen mit anderen dem Arzt verfügbaren klinischen Informationen ausgewertet werden.
- Wenn das Testergebnis negative ist und die klinischen Symptome weiter bestehen, werden weitere Teste, die andere klinische Methoden verwenden, empfohlen. Ein negatives Ergebnis schließt nicht in jedem Fall die Möglichkeit einer Rotavirus- oder Adenovirus-Infektion mit einer niedrigen Konzentration von Viruspartikeln aus.
ERWARTETE WERTE
Die Rotavirus- und Adenovirus-Combo-Schnelltestkassette (Stuhl) wurde mit einer Latex-Agglutination-Methode verglichen, und zeigte eine Gesamtgenauigkeit von >98.0%.
LEISTUNGSCHARAKTERISTIKA
Klinische Sensitivität, Spezifität und Genauigkeit
Die Leistungsfähigkeit der Rotavirus- und Adenovirus-Combo-Schnelltestkassette (Stuhl) wurde im Vergleich mit einer Latex-Agglutinations-Methode unter Verwendung von klinischen Proben, die von Kindern und jungen Erwachsenen gewonnen wurden, bewertet. Die Ergebnisse zeigen, dass die Rotavirus- und Adenovirus-Combo-Schnelltestkassette (Stuhl) eine hohe Sensitivität und Spezifität für Rotaviren und Adenoviren besitzt.
| Methode |
Latex-Agglutination |
Gesamtergebnisse |
| Rotavirus-Schnelltest |
Ergebnisse |
Positiv |
Negativ |
| Positiv |
201 |
4 |
205 |
| Negativ |
0 |
181 |
181 |
| Gesamtergebnisse |
201 |
185 |
386 |
Relative Sensitivität: >99.9% (95%CI:*98.5%-100%)
Relative Spezifität: 97.8% (95%CI:*94.6%-99.4%)
Relative Genauigkeit: 98.9% (95%CI:*97.4%-99.7%) *Konfidenzintervalle
| Methode |
Latex-Agglutination |
Gesamtergebnisse |
| Adenovirus-Schnelltest |
Ergebnisse |
Positiv |
Negativ |
| Positiv |
63 |
1 |
64 |
| Negativ |
0 |
197 |
197 |
| Gesamtergebnisse |
63 |
198 |
261 |
Relative Sensitivität: >99.9% (95%CI:*95.4%-100%)
Relative Spezifität: 99.5% (95%CI:*99.2%-100%)
Relative Genauigkeit: 99.6% (95%CI:*97.9%-100%) *Konfidenzintervalle
Präzision
Intra-Assay
Die chargeninterne Präzision wurde durch die Verwendung von 10 Wiederholungen von sieben Proben bestimmt: einige negative, eine Rotavirus schwachpositive, eine Adenovirus schwachpositive, eine Rotavirus mittelpositive, eine Adenovirus mittelpositive, eine Rotavirus starkpositive und eine Adenovirus starkpositive. Die Proben wurden insgesamt zu >99% korrekt erkannt.
Inter-Assay
Die Präzision zwischen den Chargen wurde mit 10 unterschiedlichen Tests mit denselben sieben Proben bestimmt: einige negative, eine Rotavirus schwachpositive, eine Adenovirus schwachpositive, eine Rotavirus mittelpositive, eine Adenovirus mittelpositive, eine Rotavirus starkpositive und eine Adenovirus starkpositive. Die Proben wurden insgesamt zu >99% korrekt erkannt.
Kreuzreaktivität
Die Kreuzreaktivität mit folgenden Organismen wurde bei 1,0 x 109 Organismen/ml untersucht. Die folgenden Organismen wurden beim Testen mit der Rotavirus- und Adenovirus-Combo-Schnelltestkassette (Stuhl) als negative befunden.
Staphylococcus aureus
Pseudomonas aeruginosa
Enterococcus faecalis
Group C Streptococcus
Klebsiella pneumoniae
Branhamella catarrhalis
Candida albicans |
Proteus mirabilis
Acinetobacter spp
Salmonella choleraesius
Gardnerella vaginalis
Acinetobacter calcoaceticus
E.coli
Chlamydia trachomatis |
Neisseria gonorrhea
Group B Streptococcus
Proteus vulgaris
Enterococcus faecium
Hemophilus influenzae
Neisseria meningitidis |
QUALITÄTSSICHERUNG UND VORKOMMNISSE
Sollten Sie den Eindruck eines Qualitätsmangels haben oder unklare oder ihrerseits falsch-positive oder falsch-negative Ergebnisse erhalten, bitten wir Sie, die betreffende Patientenprobe zurückzustellen und für einen Abruf für uns bereitzuhalten.
Bitte informieren Sie uns umgehend. Sie helfen uns dadurch die Sicherheit der Produkte und damit die Qualität zu gewährleisten.
LITERATUR
- Wadell, G. Laboratory Diagnosis of Infectious Diseases: Principles and Practices. New York: Springer-Verlag, Volume II, 1988: 284-300.
- WILHELMI I, ROMAN E, SANCHEZ-FAUQUIER A. Viruses causing gastroenteritis. Clin Microbiol Infect. April. 2003, vol.9:247-262
- Cubitt, WD (1982) Rotavirus Infection: An Unexpected Hazard in Units Caring for the Elderly. Geriatric Medicine Today 1: 33-38
- Hung, T et al (1984) Waterborne outbreak of Rotavirus Diarrhoea in Adults in China caused by a Novel Rotavirus. Lancet, May 26;1(8387): 1139-1142
- Cukor, G; Perron, DM; Hudson, R and Blacklow, NR (1984) Detection of Rotavirus in Human Stools by Using Monoclonal Antibody. J. Clin. Microl. 19: 888-892
- Wood, D. J. and A. S. Bailey. “Detection of Adenovirus Types 40 and 41 in Stool Specimens by Immune Electron Microscopy.” Journal of Medical Virology, 1987; 21: 191-199.
- Nishio, Osamu, M. Ooseto, K. Takagi, Y. Yamasita, Y. Ishihara, and S. Isomura. “Enzyme-Linked Immunosorbent Assay Employing Monoclonal Antibodies for Direct Identification of Enteric Adenoviruses (Ad40, 41) in Feces.” Microbiol. Immunol. 1990; 34(10): 871-877.
- Wood, D. J., K. Bijlsma, J. C. de Jong, and C. Tonkin. “Evaluation of a Commercial Monoclonal Antibody-Based Enzyme Immunoassay for Detection of Adenovirus Types 40 and 41 in Stool Specimens.” Journal of Clinical Microbiology, June 1989; 27(6): 1155-1158.
- Thomas, Eva. E., D. Roscoe, L. Book, B. Bone, L. Browne, and V. Mah. “The Utility of Latex Agglutination Assays in the Diagnosis of Pediatric Viral Gastroenteritis.” Am. J. Clin. Pathol. 1994; 101:742-746.
SYMBOLERKLÄRUNG
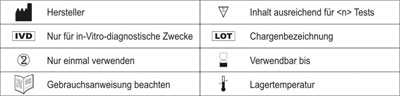
 |
Hersteller: |

Günter Keul GmbH
Von-Langen-Weg 10
D-48565 Steinfurt
Tel.: 02551/2097 Fax.: 02551/80883
Web: www.keul.de
|
(akt. 27.04.2016)
|
|