Keul-o-test®
HAV
KGST304
Ein schneller Ein-Schritt-Test für den qualitativen Nachweis Hepatitis A in Fäces. Nur für den professionellen Gebrauch in der In vitro-Diagnostik.
Verwendungszweck
Der HAV-Test ist ein immunchromatographischer Schnelltest für den qualitativen Nachweis von Hepatitis A-Antigenen in Fäces-Proben zur Verwendung in der Diagnose von HAV-Infektionen.
Zusammenfassung
Bei dem Hepatitis A-Virus handelt es sich um ein Einzelstrang-RNA-Virus, das zur Familie der Picornaviridae-Viren gehört. Die Mehrzahl akuter HAV-Infektionen verläuft subklinisch. Auftretende Symptome sind zumeist schwach und unspezifisch und umfassen vor allem Fieber, allgemeines Unwohlsein, Müdigkeit, abdominelle Beschwerden sowie Störungen des Darmtrakts. Bei schweren Infektionen können eine Dunkelfärbung des Urins, blasser Stuhl und Gelbsucht auftreten. Der Schweregrad akuter HAV-Infektionen ist proportional zum Patientenalter. Dabei tritt bei jüngeren Patienten zumeist eine leichtere Erkrankung auf als bei älteren Patienten.
Die Verbreitung von HAV erfolgt durch fäkale Verunreinigungen von Nahrung oder Trinkwasser. Obgleich das Virus im Blut vorliegt, führt die geringe Menge an zirkulierendem Virus sowie die kurze Dauer der Virämie dazu, dass eine parenterale Übertragung dieses Virus äußerst ungewöhnlich ist. Die Fäces infizierter Individuen enthalten das Virus tendenziell für einen Zeitraum von 2 Wochen vor bis 2 Wochen nach dem Ausbruch der Krankheit. In einigen Fällen ist das Virus sogar bis hin zu 3 Monate nach dem Ausbruch der Krankheit im Stuhl enthalten.
Akute Hepatitis A stellt eine der am besten untersuchten Krankheiten dar, der durch eine Impfung vorgebeugt werden kann. In Populationen mit einem hohen Infektionsrisiko wird eine aktive Hepatitis A-Virus (HAV)-Impfung empfohlen.
Der HAV-Test erlaubt einen schnellen Nachweis von Hepatitis A direkt aus Fäces-Proben.
Prinzip
Der HAV-Test ist ein qualitativer Lateralfluss-Immunassay für den Nachweis von Hepatitis A-Virus in Fäces-Proben. Die Membran der Testvorrichtung ist im Bereich der Testbande mit monoklonalen Maus-Antikörpern gegen Hepatitis A-Virusantigene vorbeschichtet.
Während der Testdurchführung reagiert die Probe mit den Partikeln, die mit Antikörpern gegen das Hepatitis A-Virus beschichtet sind und auf dem Teststreifen aufgetrocknet sind. Die Mischung aus Probe und Farbpartikeln wandert durch Kapillarwirkung entlang der Membran. Bei einem positiven Ergebnis reagieren die spezifischen Antikörper auf der Membran mit dem entstandenen Konjugat und bilden eine Farbbande. Die Mischung wandert weiter entlang der Membran zu der Position der Kontrollbande, an der sich immobilisierter Antikörper befindet. Unabhängig vom Testergebnis erscheint im Bereich der Kontrollbande immer eine GRÜNE Farbbande. Das Erscheinen der GRÜNEN Bande dient als interne Kontrolle für die Reagenzien sowie als Nachweis dafür, dass ein ausreichendes Volumen pipettiert wurde und die Mischung korrekt gewandert ist.
Vorsichtsmaßnahmen
- Nur für den professionellen Gebrauch in der In vitro-Diagnostik.
- Verwenden Sie das Produkt nach Ablauf des Verfallsdatums nicht mehr.
- Der Test sollte erst unmittelbar vor der Verwendung aus der Folientasche entnommen werden.
- Verwenden Sie den Test nicht, wenn die Folientasche beschädigt ist.
- Befolgen Sie die Grundsätzen Guter Laborpraxis. Tragen Sie Schutzkleidung und verwenden Sie Einweghandschuhe, Essen, trinken oder rauchen Sie nicht am Arbeitsplatz.
- Alle Proben sollte als mögliche Risikostoffe eingestuft und entsprechend infektiösem Material (Krankheitserregern) behandelt werden.
- Nach der Testdurchführung sollte die Testvorrichtung in einem geeigneten Behälter für biologische Risikostoffe entsorgt werden.
- Die Testdurchführung muss innerhalb von 2 Stunden nach dem Öffnen der versiegelten Folientasche erfolgen.
Lagerung und Stabilität
Lagern Sie das Produkt in der ungeöffneten, versiegelten Folientasche entweder im Kühlschrank oder bei Raumtemperatur (2-30ºC/36-86ºF). Der vorliegende Test ist bis zum Ablauf des auf der versiegelten Folientasche aufgedruckten Verfallsdatums stabil. Der Test darf erst unmittelbar vor Gebrauch aus der versiegelten Folientasche entnommen werden. Frieren Sie das vorliegende Produkt nicht ein.
Enthaltenes Material
- Testvorrichtungen
- Gebrauchsanleitung
- Probenahmefläschchen mit Puffer
Benötigtes, nicht enthaltenes Material
- Probenahmebehälter
- Einweghandschuhe
- Kurzzeitmesser
Probenahme und Vorbereitung
Nehmen Sie eine ausreichende Menge Fäces-Probe (1-2 g oder ml bei flüssigen Proben). Die Probenahme von Stuhlproben sollte dabei unter Verwendung sauberer und trockener Behälter erfolgen. (Verwenden Sie keine Konservierungsmittel oder Transportmedien.). Bis zur Testdurchführung kann eine Lagerung der Proben für eine Dauer von 1-2 Tagen im Kühlschrank (2-4ºC/36-40ºF) erfolgen. Für eine längere Lagerdauer müssen die Proben bei -20ºC/4ºF eingefroren gelagert werden. Gefrorene Proben müssen vor der Testdurchführung vollständig aufgetaut, auf Raumtemperatur erwärmt und so gründlich wie möglich gemischt werden.
Verfahren
Bearbeitung der Stuhlprobe (siehe Abbildung 1):
Verwenden Sie für jede Probe ein eigenes Probenahmefläschchen. Schrauben Sie den Deckel des Fläschchens ab und stecken Sie den Probenahmestab an verschiedenen Stellen in die Fäces-Probe, um die Probe aufzunehmen (ungefähr 150 mg). Stecken Sie den Probenahmestab in das Fläschchen mit dem Puffer. Schütteln Sie das Fläschchen, um eine gute Durchmischung der Probe zu gewährleisten. Nehmen Sie bei der Verwendung flüssiger Stuhlproben die Probe mit Hilfe einer Pipette auf. Pipettieren Sie 150 µl in das Probenahmefläschchen mit dem Puffer.
Testverfahren (siehe Abbildung 2):
Warten Sie mit der Testdurchführung, bis die Testvorrichtungen, die Stuhlproben und die Puffer Raumtemperatur erreicht haben (15-30ºC/59-86ºF). Öffnen Sie die Folientasche erst unmittelbar vor der Testdurchführung.
- Entnehmen Sie die HAV-Testvorrichtung aus der versiegelten Folientasche und verwenden Sie die Testvorrichtung so bald wie möglich.
- Schütteln Sie das Probenahmefläschchen, um eine gute Durchmischung der Probe zu gewährleisten. Brechen Sie die Spitze des Fläschchens ab.
- Verwenden Sie für jede Probe eine eigene Testvorrichtung. Geben Sie genau 4 Tropfen in den Probennapf (S). Starten Sie den Kurzzeitmesser.
- Lesen Sie das Ergebnis 15 Minuten nach der Zugabe der Probe ab.
Abbildung 1
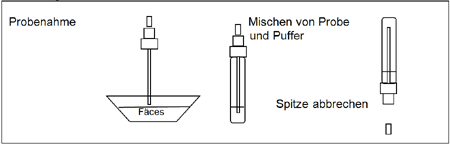
Abbildung 2

Ergebnisauswertung
Abbildung 3

POSITIV: Im zentralen Fenster der Testvorrichtung erscheinen zwei Banden. Im Bereich der Ergebnisbande erscheint eine rote Testbande, die mit dem Buchstaben T gekennzeichnet ist. Im Bereich der Kontrollbande erscheint eine grüne Kontrollbande, die mit dem Buchstaben C gekennzeichnet ist.
NEGATIV: Im Bereich der mit dem Buchstaben C markierten Kontrollbande erscheint nur eine grüne Bande.
UNGÜLTIG: Ein vollständiges Fehlen der grünen Kontrollbande, unabhängig vom Auftreten der roten Testbande. Hinweis: Hinweis: Die Hauptursache für das Fehlen der Kontrollbande ist ein unzureichendes Probenvolumen, eine inkorrekte Testdurchführung oder die Verwendung unbrauchbarer, verdorbener Reagenzien. Überprüfen Sie das Testverfahren und wiederholen Sie den Test unter Verwendung einer neuen Testvorrichtung. Tritt das Problem weiterhin auf, dann verwenden Sie das Test-Kit nicht mehr und kontaktieren Sie Ihren lokalen Vertriebshändler.
Hinweis zur Ergebnisauswertung
Die Intensität der roten Farbbande im Bereich der Ergebnisbande (T) variiert in Abhängigkeit von der Konzentration des viralen Antigens in der Probe. Unter Verwendung des vorliegenden qualitativen Tests können jedoch weder der quantitative Wert noch die Steigerungsrate der Antigenkonzentration bestimmt werden.
Qualitätskontrolle
Der vorliegende Test beinhaltet interne Verfahrenskontrollen:
- Im Bereich der Kontrollbande (C) erscheint eine grüne Bande. Sie zeigt an, dass ein ausreichendes Probevolumen verwendet und der Test korrekt durchgeführt worden ist.
Einschränkungen
- Die Testdurchführung muss innerhalb von 2 Stunden nach dem Öffnen der versiegelten Folientasche erfolgen.
- Ein Probenüberschuss (Überschuss von Stuhlprobe) kann falsche Ergebnisse zur Folge haben. (Es treten braune Banden auf.). Verdünnen Sie die Probe unter Verwendung des Puffers und wiederholen Sie den Test.
- Einige Fäces-Proben können eine Verringerung der Intensität der Kontrollbande zur Folge haben.
- Einen Monat nach der Infektion nimmt die Virenzahl in den Fäces ab. Dies hat zur Folge, dass die Probe weniger reaktiv ist. Fäces-Proben sollten vor dem Einsetzen der Symptome genommen werden, um eine Verbreitung der Viren zu verhindern.
- Der vorliegende Test bietet eine präsumptive Diagnose einer HAV-Infektion. Die Bestätigung der Diagnose einer Infektion sollte nur durch einen Arzt nach Auswertung aller klinischen Befunde und Laborbefunde erfolgen. Die bestätigte Diagnose muss auf der Korrelation der Ergebnisse mit weiteren klinischen Beobachtungen basieren.
Erwartungswerte
Der Schweregrad akuter HAV-Infektionen ist proportional zum Patientenalter. Dabei neigen jüngere Patienten zu schwächeren Erkrankungen, während bei älteren Patienten die Erkrankung häufig schwerer ausgeprägt ist. Tatsächlich beträgt die Gesamtmortalitätsrate in der Allgemeinbevölkerung nur 0,1%, bei Älteren jedoch 1-2%.
Leistungsmerkmale
Sensitivität und Spezifität
Unter Verwendung des vorliegenden HAV-Tests wurden 26 Stuhlproben untersucht. Die Ergebnisse dieser Untersuchung wurden mit Hilfe des HAV-Antigen EIA Assay (Mediagnost®) bestätigt. Die Ergebnisse ergaben sowohl für die Sensitivität als auch für die Spezifität einen Wert von >99%.
Die für die Herstellung des vorliegenden Tests verwendeten Antikörper erkennen HAV-Epitope, die in Stuhlproben von Patienten nachgewiesen wurden.
Die dargestellten vorläufigen Werte gelten unter Vorbehalt, bis weitere Daten zur Bewertung zur Verfügung stehen.
Kreuzreaktivität
Zur Bestimmung der Kreuzreaktivität des HAV-Tests wurde eine Auswertung durchgeführt. Es liegt keine Kreuzreaktivität mit verbreiteten Darmkeimen oder mit anderen in Fäces vorliegenden Organismen und Substanzen vor: Rotavirus, Adenovirus, Astrovirus, Enterovirus, Norovirus.
Literatur
- MINUK, G.Y. et al. „Viral hepatitis and surgeon“. HPB, 2005; 7: 56-64.
- BRUGUERA, M. et al. „Prevención de las hepatitis virales“. Enferm Infecc Microbiol Clin. 2006;24:649-56.
Qualitätssicherung und Vorkommnisse
Sollten Sie den Eindruck eines Qualitätsmangels haben oder unklare oder ihrerseits falsch-positive oder falsch-negative Ergebnisse erhalten, bitten wir Sie, die betreffende Patientenprobe zurückzustellen und für einen Abruf für uns bereitzuhalten.
Bitte informieren Sie uns umgehend. Sie helfen uns dadurch die Sicherheit der Produkte und damit die Qualität zu gewährleisten.
 |
Hersteller: |

Günter Keul GmbH
Von-Langen-Weg 10
D-48565 Steinfurt
Tel.: 02551/2097 Fax.: 02551/80883
Web: www.keul.de |
|