| |
Keul-o-test
Borreliose IgM
KGST198
DIMDI Reg.-Nr.: DE/CA22/1116-129-IVD
Immunchromatographischer Schnelltest zum Nachweis von anti-Borrelia IgM-Antikörpern in Vollblut-, Plasma- oder Serumproben

I – PRINZIP
Die Lyme-Krankheit (1) oder Borreliose wird durch die von Zecken übertragene Spirochäte Borrelia burgdorferi verursacht. Die mit Borrelia burgdorferi senso lato infizierten, kontaminierenden Insekten kommen vor allem in Nordamerika (Ixodes scapularis oder I. pacificus) sowie in den gemäßigten Zonen Westeuropas (Ixodes ricinus) vor. Die europäische Zeckenart ist Überträger von Borrelia burgdorferi, B. afzelli und B. garinii (2).
In 30 bis 80 % der Fälle ist eine Hautrötung, das sogenannte Erythema migrans,
das erste klinische Zeichen einer Infektion. Diese Hautrötung tritt nach 3 bis 10 Tagen am Ort des Insektenbisses auf. Nach 1 bis 3 Monaten treten die ersten neurologischen Symptome, Kopfschmerzen oder erste Erkrankungen wie beispielsweise Myelitis (3), auf, sogar in Abwesenheit des Erythema migrans. Im weiteren Verlauf können die Patienten schwere Komplikationen wie intermittierende Anfälle von artikulärer Arthritis, Myocarditis oder Acrodermatitis entwickeln. Diese können mehrere Jahre nach der Primärinfektion auftreten.
Bei Keul-o-test Borreliose IgM handelt es sich um einen schnellen, qualitativen Screening-Test zum Nachweis humaner, gegen europäische Borrelia-Stämme gerichteter IgM-Klasse-Antikörper in
Serum, Plasma oder Vollblut.
Die vorliegende Methode verwendet für den spezifischen Nachweis von anti-Borrelia-Antikörpern eine einzigartige Kombination von anti-humanen, Farbstoff-konjugierten Immunglobulinen und hochaufgereinigten Borrelia-Antigenen auf der Festphase.
Bei Durchtritt der Proben durch die Absorptionseinheit binden die anti-humanen, Farbstoff-konjugierten Immun-globuline unter Bildung eines Antikörper-Antigen-Komplexes an die humanen IgM-Antikörper. Dieser Komplex bindet an die spezifischen Antigene in der positiven Reaktionszone und führt zur Ausbildung einer rosarot gefärbten Bande. Bei Fehlen von anti-Borrelia-Antikörpern liegt keine Bande in der positiven Reaktionszone vor. Im Verlauf durchtritt das Reaktionsgemisch die Reaktions- und Kontrollzonen der Absorptionseinheit. Nicht gebundenes Konjugat bindet an die Reagenzien in der Kontrollzone. Die Ausbildung einer rosaroten Farbbande zeigt an, dass die Reagenzien korrekt funktionieren.
II – KOMPONENTEN DES Keul-o-test Borreliose IgM -KITS
Jedes Kit enthält sämtliche für die Durchführung der Tests erforderlichen Komponenten.
- Keul-o-test Borreliose IgM-Testvorrichtungen
- Einweg-Plastikpipetten
- Verdünnungslösung in einer Tropfflasche
(Salinepuffer, Detergenz und Natriumazid (NaN3 < 0.1%))
- Gebrauchsanleitung
III – LAGERUNG UND STABILITÄT
- Sämtliche Komponenten des Keul-o-test Borreliose IgM -Kits sollten bei +2°C bis +30°C in der versiegelten Folientasche gelagert werden.
- Frieren Sie das Test-Kit nicht ein.
- Das Keul-o-test Borreliose IgM ist bis zum Erreichen des auf dem Verpackungsetikett angegebenen Verfallsdatums stabil.
IV – VORSICHTSMASSNAHMEN
- Der vorliegende Test wurde ausschließlich für den professionellen Gebrauch in der In vitro-Diagnostik entwickelt.
- Lesen Sie vor der Durchführung des Tests sorgfältig die Gebrauchsanleitung.
- Verwenden Sie den Test nicht nach Ablauf des auf dem Verpackungsetikett angegebenen Verfallsdatums.
- Verwenden Sie keinen Test, dessen Schutzhülle beschädigt ist.
- Handhaben Sie alle biologischen Proben entsprechend infektiösem Material. Entsorgen Sie die Proben sowie alle weiteren mit diesem Kit verwendeten Materialien nach Beendigung der Testdurchführung entsprechend biologischem Abfall.
- Tragen Sie während der Probenanalyse Schutzkleidung wie beispielsweise einen Labormantel sowie Einweghandschuhe.
- Essen, trinken oder rauchen Sie nicht in dem Bereich, der für die Handhabung der Proben und der Kit-Reagenzien vorgesehen ist.
- Vermeiden Sie während der Probenahme und -analyse jeden Kontakt zwischen den Händen und den Augen oder der Nase.
V – PROBENAHME UND -VORBEREITUNG
Serum, Plasma (Lithium- oder Ammonium-Heparinate, EDTA) oder Vollblut
- Die Probenahme sollte unter Standard-Laborbedingungen erfolgen (aseptisch zur Vermeidung von Hämolyse).
- Bei Durchführung des Tests mit Vollblut sollten frische Proben verwendet werden (< 4 Stunden).
- Soll die Testdurchführung innerhalb von 48 Stunden nach Probenahme erfolgen, sollte die Probe im Kühlschrank (+2°C bis +8°C) gelagert werden. Bei einer zeitverzögerten Testdurchführung nach mehr als 48 Stunden sollte die Probe eingefroren werden. Vor der Testdurchführung muss die eingefrorene Probe vollständig aufgetaut, gründlich gemischt und auf Raumtemperatur erwärmt werden. Vermeiden Sie ein wiederholtes Einfrieren und Auftauen von Proben.
- Bei Trübung, hoher Viskosität oder Vorliegen von Feststoffen sollten Serumproben vor der Analyse mit dem gleichen Volumen (V/V) von Verdünnungspuffer (nicht enthalten, jedoch auf Anfrage erhältlich) verdünnt werden.
VI – TESTDURCHFÜHRUNG
- Erwärmen Sie die Proben und die Keul-o-test Borreliose IgM -Testvorrichtungen vor der Analyse auf Raumtemperatur.
- Reißen Sie die Schutzhülle an der dafür vorgesehenen Trennnaht auf und entnehmen Sie die Reaktionseinheit.
- Kennzeichnen Sie die Vorrichtung mit dem Namen oder der Kontrollnummer des Patienten.
- Füllen Sie die Auftropfvorrichtung mit Probe (Serum oder Plasma). Halten Sie die Auftropfvorrichtung senkrecht und pipettieren Sie einen Tropfen (25 µl) in die dafür vorgesehene Vertiefung. Pipettieren Sie bei Verwendung von Vollblut zwei Tropfen (50µl) in die Vertiefung.
- Geben Sie exakt 5 oder 6 Tropfen der Verdünnungslösung (200 µl) in die Vertiefung.
- Lesen Sie die Ergebnisse nach 10 bis 15 Minuten ab.
NEHMEN SIE NACH MEHR ALS 15 MINUTEN KEINE AUSWERTUNG MEHR VOR
VII – TESTAUSWERTUNG
| A. Negativ
In dem Kontrollbereich erscheint eine farbige Bande. |
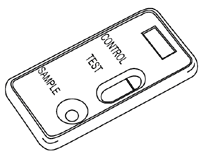 |
| B. Positiv
Zusätzlich zur Kontrollbande erscheint auch eine deutlich erkennbare Bande im Testbereich. |
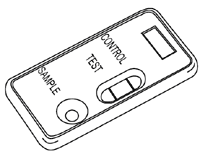 |
| C. Nicht eindeutig
Ist im Kontrollbereich keine distinkte Bande sichtbar, ist der Test nicht eindeutig. Wiederholen Sie in diesem Fall den Test. |
|
VIII – PERFORMANZMERKMALE
a) Kreuzreaktionen
Der Keul-o-test Borreliose IgM-Schnelltest ergab in 100% der Fälle bei Verwendung von gegen den internationalen W.H.O.-Standard n° 3-1980 kalibriertem Syphilis-positivem Kontroll-serum negative Ergebnisse.
b) Sensitivität und Spezifität
Zwei Panels von 9 beziehungsweise 30 mit EIA-Methoden prä-analysierten Seren wurden unter Verwendung des Keul-o-test Borreliose IgM-Schnelltests getestet. Die Ergebnisse sind in Tabelle I zusammengefasst.
Tabelle I
|
|
EIA-Referenzmethoden
|
|
|
Keul-o-test
Borreliose IgM
|
|
+
|
+/-
|
–
|
Gesamt
|
|
+
|
18
|
3
|
3
|
24
|
|
+/-
|
0
|
0
|
0
|
3
|
|
–
|
2
|
0
|
13
|
15
|
|
Gesamt
|
20
|
3
|
16
|
39
|
Die Berechnung der Leistungen erfolgt unter Verwendung der in Tabelle I angegebenen Daten wie nachfolgend beschrieben:
Sensitivität: (18+3) x 100 = 91.3 %
(20+3)
Spezifität: 13 x 100 = 81.3 %
16
Allgemeine Übereinstimmung: (21+13) x 100 = 87.2 %
(23+16)
IX – EINSCHRÄNKUNGEN
- Wie bei jedem diagnostischen Verfahren sollte der Arzt eine Evaluation der durch den Test erhaltenen Daten unter Berücksichtigung weiterer klinischer Informationen vornehmen, da Patienten, die unter Borreliose leiden, Symptome zeigen könnten, die jenen der Syphilis gleichen (4).
- Antikörperkonzentrationen variieren in Abhängigkeit von den getesteten Patienten. Die Prävalenz in der Gesamtbevölkerung liegt bei 3-5%, während in exponierten Testpersonen (Waldarbeiter, Wanderer) in 25 -30 % der Fälle Antikörper nachgewiesen werden konnten (5).
- Sehr frühe Infektionsstadien können aufgrund der geringen Konzentration von anti-Borrelia-Antikörpern in den Serum-, Plasma- oder Vollblutproben zu falsch negativen Ergebnissen führen.
- Ein positives Ergebnis schließt das Vorliegen weiterer Pathogene nicht aus. Es können Kreuzreaktionen mit Syphilis oder anderen nicht sexuell übertragbaren Treponema-Infektionen auftreten. Ebenfalls beobachtet wurden Kreuz-reaktionen mit IgM-Klasse-Antikörpern in Fällen von Auto-immunerkrankungen oder durch Herpesviridae verursachten Infektionen (5).
X- LITERATUR
- Marques, A.R., Hornung, R.L., Dally, L. and Philipp, M.T. 2005. Detection of Immune Complexes is not independent of detection of antibodies in Lyme disease patients and does not confirm active infection with Borrelia burgdorferi. Clinical and Diagnostics Laboratory Immunology, 12/9: 1036-1040.
- Lyme Disease and Related Tick-Borne infections. 2001. Southwestern Vermont Health Care.
- Nadelman, R.B. and Wormser, G.P. 1998. Lyme borreliosis. Lancet 352 : 557-565.
4. Duray, P.H. 1989. Clinical pathologic correlations of Lyme disease. Reviews of Infectious Diseases. 11/6 : S1487-S1493.
- Bertholom, C. 2007. Place et intérêt des méthodes du diagnostic biologique au cours de la borréliose de Lyme. Option Bio. 387 : 20-21.
Qualitätssicherung und Vorkommnisse
Sollten Sie den Eindruck eines Qualitätsmangels haben oder unklare oder ihrerseits falsch-positive oder falsch-negative Ergebnisse erhalten, bitten wir Sie, die betreffende Patientenprobe zurückzustellen und für einen Abruf für uns bereitzuhalten.
Bitte informieren Sie uns umgehend. Sie helfen uns dadurch die Sicherheit der Produkte und damit die Qualität zu gewährleisten.
Abrechnung
| |
Nr. |
Preis in € |
| GOÄ |
4220 |
5,25 |
 |
Hersteller: |

Günter Keul GmbH
Von-Langen-Weg 10
D-48565 Steinfurt
Tel.: 02551/2097 Fax.: 02551/80883
Web: www.keul.de |
|
|