| |
Keul-o-test
Influenza A/B Complete
Für Abstriche von der Nasenschleimhaut
KGST182
DIMDI Reg.-Nr.: DE/CA22/1116-136-IVD
| 2. Mai 2009
Wichtige Information:
Der Keul-o-test Influenza-A/B ist klassifiziert nach dem Kerneiweiß für den A- oder B-Typ, so sind H und N (H1N1, H2N2, H3N2,H3N8, H5N1, H6H2, H7N7, H9N2) Proteine der Oberfläche. Die Sensitivität bzw. Spezifität des Keul-o-test Influenza A/B Complete beträgt 84,4% bzw. 94,7% für A Stämme und 84,3% bzw. 95,5% für B Stämme relativ zum RT-PCR-Verfahren.
Unser Grippe A und B-2-Panel-Test ist so konzipiert, dass das Grippe-A-und B-Kerneiweiß unabhängig vom Oberflächenprotein erkannt wird. Hierzu gehört auch das H1N1-Influenza-A.
Günter Keul
QM-Manager

Günter Keul GmbH
Von-Langen-Weg 10
D-48565 Steinfurt/Germany
Tel.: 02551 / 2097 Fax.: 02551 / 80883
e-mail: info@keul.de website: www.keul.de
Lieferanschrift/shipping address:
Von-Langen-Weg 10
D-48565 Steinfurt/Germany |
VERWENDUNGSZWECK
Beim Keul-o-test Influenza A/B Complete handelt es sich um einen qualitativen In vitro-Schnelltest zum Nachweis von aus Atemwegsproben gewonnenen Antigenen (Nukleoproteinen) von Influenza Typ A und B. Der Test wurde zum Nachweis von Nukleoproteinen der A- und B-Core-Subtypen, unabhängig von den H- und N-Oberflächenproteinen, entwickelt. Ausschließlich für den professionellen Gebrauch.
ARBEITSWEISE
Die Keul-o-test Influenza A/B ist ein Sandwich-Immunoassay Test. Die Test-Kassette enthält eine Nitrozellulose-Membran immobilisierte Streifen mit einem Maus Grippe-Antikörper im Testreaktionfeld (T). Ein weiterer Antikörper, ein goatanti – Maus-Antikörper ist in der Kontrollgruppe der Reaktionszone (C) an die immobilisierte Nitrocellulosemembran gebunden.
LAGERUNG
Das Keul-o-test Influenza A/B Complete sollte in der original versiegelten Folientasche bei Raumtemperatur gelagert werden. Die Bestimmung des Haltbarkeitsdatums erfolgte unter normalen Laborbedingungen.
ENTHALTENES MATERIAL
- Influenza A/B Complete-Testkassette
- Gebrauchsanleitung.
- Tupfer.
- Teströhrchen
- Extraktionspuffer.
|
 |
VORSICHTSMASSNAHMEN
Der Keul-o-test Influenza A/B Complete sollte bei Raumtemperatur (2-30°C /36-86°F) gelagert werden. Die Testkassette ist empfindlich gegenüber Feuchtigkeit sowie Hitze. Führen Sie den Test unmittelbar nach Entnahme der Testkassette aus der Folientasche durch. Verwenden Sie den Test nicht nach Ablauf des Haltbarkeitsdatums.
WARNHINWEISE
- Ausschließlich zum Gebrauch in der In vitro-Diagnostik.
- Essen oder rauchen Sie nicht während des Umgangs mit den Proben.
- Tragen Sie bei Umgang mit den Proben Schutzhandschuhe und waschen Sie sich im Anschluss sorgfältig die Hände.
- Vermeiden Sie ein Verschütten von Proben sowie eine Aerosolbildung.
- Beseitigen Sie durch Proben verursachte Kontaminationen sorgfältig unter Verwendung eines geeigneten Desinfektionsmittels.
- Dekontaminieren Sie sämtliche Proben, Reaktions-Kits sowie potentiell kontaminierten Materialien und entsorgen Sie sie entsprechend infektiösem Abfall in einem Behälter für biologische Risikostoffe.
- Verwenden Sie den Test nicht, falls die Folientasche beschädigt oder das Siegel gebrochen ist.
PROBENAHME
- Führen Sie den sterilen Tupfer in das Nasenloch ein, welches die stärkste Sekretion zeigt.
- Führen Sie mit dem Tupfer sehr vorsichtig eine Dreh- und Vorwärtsbewegung aus, bis Sie auf Höhe der Nasenmuschel auf Widerstand stoßen.
- Drücken Sie den Tupfer vorsichtig gegen die Nasenwand und führen Sie behutsam mehrfach eine Drehbewegung aus.
PROBENVORBEREITUNG
- Geben Sie 12 Tropfen Extraktionspuffer in das Teströhrchen.
- Führen Sie den Probentupfer in das Röhrchen ein. Drehen Sie den Tupfer für eine Durchmischung der Reagenzien mindestens 1 Minute lang kräftig hin und her.
- Pressen Sie anschließend so viel Flüssigkeit wie möglich aus dem Tupfer. Drücken Sie hierzu den Faserteil des Tupfers unter Drehbewegungen gegen die Röhrchenwand. Verwerfen Sie den Tupfer. Mischen Sie den Inhalt des Röhrchens durch vorsichtiges Schwenken. Die Mischung ist bereit für die Testdurchführung.
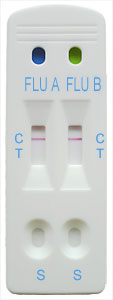
TESTDURCHFÜHRUNG
- Entnehmen Sie die Testkassette aus der Folientasche und legen Sie sie auf eine ebene, trockene Arbeitsfläche.
- Halten Sie die Pipette über die Testkassette. Applizieren Sie durch Zusammendrücken der Pipette jeweils 4 hängende Tropfen der Probenmischung in die dafür vorgesehenen Probenöffnungen (Abbildung 1). Warten Sie, bis die einzelnen Tropfen absorbiert worden sind, bevor Sie einen neuen Tropfen hinzugeben. Hinweis: Wenn die Tropfen viele Luftblasen enthalten, kann die Probenmenge geringer als das erforderliche Minimum sein. Wenn nach etwa 30 Sekunden keine rote Farbfront durch das Ergebnisfenster zieht, fügen Sie noch einen oder mehrere Tropfen hinzu.
- Nach Testbeginn bewegt sich ein violetter Farbstoff in dem Ergebnisfenster in der Mitte der Testkassette.
- Werten Sie die Testergebnisse nach 10 Minuten aus. Nehmen Sie nach 15 Minuten keine Auswertung der Testergebnisse mehr vor.
Achtung: Die oben angegebene Inkubationszeit basiert auf der Annahme, dass Testdurchführung und Auswertung bei einer Raumtemperatur von 15 bis 30°C erfolgen. Beträgt die Raumtemperatur jedoch deutlich weniger als 15°C, sollte die Inkubationszeit entsprechend verlängert werden.
TESTAUSWERTUNG
- Im linken Bereich des Ergebnisfensters erscheint eine Farbbande. Bei dieser Linie handelt es sich um die Kontroll-Linie. Sie zeigt an, dass der Test ordnungsgemäß funktioniert.
- Im rechten Bereich des Ergebnisfensters werden die Testergebnisse angezeigt. Erscheint eine weitere Farbbande im rechten Bereich des Ergebnisfensters, handelt es sich um die Test-Linie.
POSITIVES ERGEBNIS: ZWEI FARBBANDEN
Das Vorliegen von zwei Farbbanden („T“-Linie und „C“-Linie) innerhalb des Ergebnisfensters zeigt, unabhängig von der Reihenfolge ihres Erscheinens, ein positives Ergebnis für den Inf-A-Test und/oder den Inf-B-Test des Inf-A-/Inf-B-Panels an (Abbildungen 2, 3 und 4). Hinweis: Im Allgemeinen gilt, dass die Färbung der „T“-Linie umso intensiver ausfällt, je höher der Analyt-Level in der Probe ist. Ist der Analyt-Level der Probe gering, liegt jedoch noch innerhalb der Nachweisgrenzen des Tests, dann fällt die Färbung der „T“-Linie sehr schwach aus.
NEGATIVES ERGEBNIS: EINE FARBBANDE
Das ausschließliche Vorliegen der Kontroll-Linie innerhalb des Ergebnisfensters zeigt ein negatives Ergebnis an (Abbildung 5).
KEIN ERGEBNIS:
Ist nach der Testdurchführung keine Kontroll-Linie innerhalb des Ergebnisfensters sichtbar, ist das Ergebnis nicht gültig. Mögliche Ursachen sind: Ein Nichtbefolgen der Gebrauchsanleitung oder ein Überschreiten des Haltbarkeitsdatums des Tests. Es wird empfohlen, die Probe unter Verwendung eines neuen Test-Kits erneut zu testen (Abbildungen 6 und 7).
Hinweis: Ein positives Ergebnis ändert sich nach Ablauf der Inkubationszeit von 10 Minuten nicht mehr. Zur Vermeidung nicht korrekter Ergebnisse sollte das Testergebnis jedoch nach mehr als 15 Minuten nicht mehr ausgewertet werden.
QUALITÄTSKONTROLLE DURCH DEN ANWENDER
In dem vorliegenden Kit sind keine Kontrollstandards enthalten. Es wird jedoch empfohlen, gemäß GLP (Gute Laborpraxis) eine Kontrolle in das Testverfahren aufzunehmen.
EINSCHRÄNKUNGEN DES TESTS
Trotz der Genauigkeit des Keul-o-test Influenza A/B Complete beim Nachweis von Influenza A/B-Virus können falsche Ergebnisse auftreten. Bei Erhalt nicht eindeutiger Ergebnisse ist die Durchführung weiterer klinisch verfügbarer Tests erforderlich. Bei dem Keul-o-test Influenza A/B Complete handelt es sich um einen qualitativen Assay. Die in der Probe vorliegende Konzentration von Influenza A- oder B-Virus kann mit Hilfe des vorliegenden Assays nicht bestimmt werden. Die Ergebnisse des vorliegenden Assays ermöglichen ausschließlich eine Unterscheidung zwischen positiven und negativen Proben. Wie bei allen diagnostischen Tests sollte eine endgültige klinische Diagnose nicht auf den Ergebnisse eines einzelnen Tests basieren, sondern sollte vom Arzt nach Evaluation sämtlicher klinischer Befunde und Laborbefunde erstellt werden.
SENSITIVITÄT UND SPEZIFITÄT
Der Test wurde hinsichtlich seiner relative Sensitivität und Spezifität mit dem RT-PCR verglichen: Die Sensitivität bzw. Spezifität des Keul-o-test Influenza A/B Complete beträgt 84,4% bzw. 94,7% für A Stämme und 84,3% bzw. 95,5% für B Stämme relativ zum RT-PCR-Verfahren.
Sensitivitäts -Test des Keul-o-test Influenza A/B Complete im Vergleich mit einer Viruskultur und Test (n = 300).
| |
Kultur |
|
| + |
– |
| Keul-o-test Influenza A/B Complete |
+ |
114 |
12 |
126 |
| – |
36 |
138 |
174 |
| |
150 |
150 |
300 |
| 76% |
92% |
|
| Sensitivität |
Spezifität |
Relative Sensitivität des Keul-o-test Influenza A im Vergleich mit einer Viruskultur
| |
Kultur Flu-A |
|
| + |
– |
| Keul-o-test Influenza A |
+ |
103 |
12 |
115 |
| – |
32 |
138 |
170 |
| |
135 |
150 |
285 |
| 76.3% |
92% |
|
| Sensitivität |
Spezifität |
Relative Sensitivitär des Keul-o-test Influenza A im Vergleich RT-PCR
| |
RT-PCR (Taqman) |
|
| + |
– |
| Keul-o-test Influenza A |
+ |
114 |
8 |
122 |
| – |
21 |
142 |
159 |
| |
135 |
150 |
285 |
| 84.4% |
94.7% |
|
| Sensitivität |
Spezifität |
Relative Sensitivität des Keul-o-test Influenza B im Vergleich mit RT-PCR
| |
RT-PCR (Taqman) |
|
| + |
– |
| Keul-o-test Influenza B |
+ |
27 |
2 |
29 |
| – |
5 |
42 |
47 |
| |
32 |
44 |
76 |
| 84.3% |
95.5% |
|
| Sensitivität |
Spezifität |
SENSITIVITÄT (ANALYTISCHE SENSITIVITÄT)
Die Bestimmung der analytischen Sensitivität erfolgt durch Virustitration in embryonierten Hühnereiern
|
Virenstamm
|
Typ
|
Subtyp
|
CEID/Test
|
|
Texas 1/77
|
A
|
H3N2
|
2.9 x 103
|
|
HongKong/8/68
|
A
|
H3N2
|
6.1 x 101
|
|
Shanghai/11
|
A
|
H3N2
|
6.1 x 101
|
|
Port Chalmers
|
A
|
H3N2
|
1.25 x102
|
|
New Jersey/8/76
|
A (Schwein)
|
H1N1
|
2.5 x 102
|
|
NWS/33
|
A
|
H1N1
|
1.24 x 103
|
|
Mal/302/54
|
A
|
H1N1
|
6.73 x 103
|
|
HongKong/5/72
|
B
|
N/A
|
3.6 x 101
|
|
Taiwan
|
B
|
N/A
|
3.6 x 102
|
|
California
|
B
|
N/A
|
3.1 x 103
|
|
Stockholm
|
B
|
N/A
|
3.6 x 105
|
Darüber hinaus hat der Keul-o-test Influenza A/B Complete gezeigt, dass alle getesteten Stämme erkannt werden:
H2N2 – A/Hokkaido 17/01 (Ente)
H3N8 – A/ Monogolia/3/03 (Ente)
H5N1 – A/HongKong/156/97
H5N1 – A/Yamaguchi/7/04 (Huhn)
H5N1 – A/Thailand/MK2/04
H6H2 – A/Massachusett/3740/65 (Truthahn)
H7N7 – A/Massachusetts/1/80 (Seehund(Phoca vitulina))
H9N2 – A/Wisconsin/66 (Truthahn)
LITERATUR:
- Murphy, B.R., and R.G. Webster, 1996, Orthomyxoviruses, pp. 1397-1445. In: Fields, Virology, 3rd edition, B.N. Fields, D.M. Knipe, P.M. Howley, et al. (eds.), Lippincott-Raven, Philadelphia.
- Biosafety in Microbiological and Biomedical Laboratories, 4th Edition. U.S.Department of Health and Human Services, CDC, NIH, Washington, DC (1999).
- CDC website: http://www.cdc.gov/flu/
Abrechnung
| |
Nr. |
Preis in € |
GOÄ-
GKV Patienten mit Selbstzahlungsleistung
(IGel) einfacher Satz |
4644 |
16,76 |
Qualitätssicherung und Vorkommnisse
Sollten Sie den Eindruck eines Qualitätsmangels haben oder unklare oder ihrerseits falsch-positive oder falsch-negative Ergebnisse erhalten, bitten wir Sie, die betreffende Patientenprobe zurückzustellen und für einen Abruf für uns bereitzuhalten.
Bitte informieren Sie uns umgehend. Sie helfen uns dadurch die Sicherheit der Produkte und damit die Qualität zu gewährleisten.
 |
Hersteller: |

Günter Keul GmbH
Von-Langen-Weg 10
D-48565 Steinfurt
Tel.: 02551/2097 Fax.: 02551/80883
Web: www.keul.de |
(akt. 22.09.2015)
|
|